26、(7分)下表的实验数据是在不同温度和压强下,平衡混合物中NH3含量的变化情况。
达到平衡时平衡混合物中NH3的含量(体积分数)[ 入料V(N2)∶V(H2)=1∶3]
 NH3
压强/MPa NH3
压强/MPa 的含量 /% 的含量 /%温度/℃ |
0.1 |
10 |
20 |
30 |
60 |
100 |
|
200℃ |
15.3 |
81.5 |
86.4 |
89.9 |
95.4 |
98.8 |
|
300℃ |
2.2 |
52.0 |
64.2 |
71.0 |
84.2 |
92.6 |
|
400℃ |
0.4 |
25.1 |
38.2 |
47.0 |
65.2 |
79.8 |
|
500℃ |
0.1 |
10.6 |
19.1 |
26.4 |
42.2 |
57.5 |
|
600℃ |
0.05 |
4.5 |
9.1 |
13.8 |
23.1 |
31.4 |
(1)比较200℃和300℃时的数据,可判断升高温度,平衡向 方向移动,正反应方向为 反应。
(2)根据平衡移动原理,合成氨适宜的条件是 。
A 高温高压 B 高温低压 C 低温高压 D 低温低压
(3)计算500℃,30MPa时N2的转化率 。
(4)实际工业生产合成氨时,考虑浓度对化学平衡的影响,还采取了一些措施。请写出其中的一个措施: 。
25.(8分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
 2SO2
+ O2 2SO3 测得平衡时容器中压强是起始时压强的5/6倍,求:
2SO2
+ O2 2SO3 测得平衡时容器中压强是起始时压强的5/6倍,求: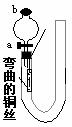 ⑴写出铜和稀硝酸反应的化学方程式____________________。
⑴写出铜和稀硝酸反应的化学方程式____________________。 _________________
______。
_________________
______。