17.(福州)小彬同学家新买了水龙头,从说明书上了解到该水龙头是铜质镀铬的。他想起在学习金属性质时用到的金属活动性顺序中没有铬,为了了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,进行如下探究活动。
[查阅资料]铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜。铬能与稀硫酸反应,生成蓝色的硫酸亚铬( CrSO4)溶液……
铝是银白色有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液……
[预 测]三种金属在金属活动性顺序中的相对位置关系:
①Cr Al Cu ②Al Cr Cu ③Al Cu Cr
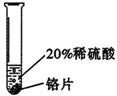
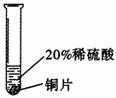
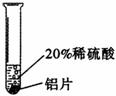
[实验过程]取大小相同的三种金属薄片,用砂纸打磨光亮。
|
|
实验一 |
实验二 |
实验三 |
|
实验 方案 |
 |
 |
 |
|
实验 现象 |
铬片表面产生气泡缓慢,溶液变蓝色。 |
_______________________ |
铝片表面产生气泡较快。 |
|
结论 |
铬能和稀硫酸发生反应,反应速率较慢。 |
铜不与稀硫酸反应 |
_______________________ |
|
三种金属在金属活动性顺序中的相对位置关系是__________________________ |
[回答问题](1)用砂纸打磨金属片的目的是_____________________。
(2)实验一所发生反应的化学方程式是____________________________。
(3)小东提出用硫酸铜溶液代替上述实验中的稀硫酸也能得出三种金属在金属活动性顺序中的相对位置关系,小燕认为不可行,理由是__________________。
(4)小清认为只要选用三种药品进行实验就可以得出三种金属在金属活动性顺序中的相对位置关系,这三种药品可以是________________。
[归 纳]比较金属活动性强弱的方法有①_____________ ② ___________ 。
29.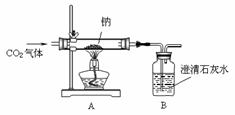 (常州)某化学课外兴趣小组为探究Na与CO2的反应进行了如下实验(实验部分装置如右图所示):向盛有Na的装置A中通入纯净、干燥的CO2,当观察到装置B中刚好出现浑浊时,点燃酒精灯,同时继续缓缓通入CO2,Na剧烈燃烧,产生白烟,燃烧结束后装置A中有黑色固体和白色固体生成。
(常州)某化学课外兴趣小组为探究Na与CO2的反应进行了如下实验(实验部分装置如右图所示):向盛有Na的装置A中通入纯净、干燥的CO2,当观察到装置B中刚好出现浑浊时,点燃酒精灯,同时继续缓缓通入CO2,Na剧烈燃烧,产生白烟,燃烧结束后装置A中有黑色固体和白色固体生成。
[资料卡]
(1)K、Ca、Na等活泼金属的氧化物均可与水反应生成对应的碱;
(2)钠为银白色金属,过氧化钠为淡黄色固体。
[提出问题]白色固体含有什么物质?
[猜想与假设]
假设1:白色固体含有 ▲ ;
假设2:白色固体含有Na2O;
[实验设计]
|
实验步骤 |
实验现象 |
实验结论 |
|
①取少量白色固体放入足量水中 |
白色固体完全溶解 |
|
|
②取①中少量溶液,加入 ▲ |
产生大量气泡 |
假设1成立 |
|
③另取①中少量溶液, ▲ |
▲ |
假设2成立 |
[反思提高]
Na在CO2中燃烧存在多个反应、生成多种物质。请你写出其中生成物仅为一种白色固体与一种黑色固体的反应的化学方程式: ▲ 。
20.(常州)如右图,一木块漂浮于X中,向X中缓缓加入(或通入)少量物质Y后最终木块上浮,则X与Y可能是(溶液的体积变化忽略不计)
|
序号 |
X |
Y |
|
① |
水 |
食盐 |
|
② |
氢氧化钙溶液 |
二氧化碳 |
|
③ |
稀硫酸 |
镁粉 |
|
④ |
硫酸铜溶液 |
铁粉 |
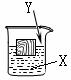
A.②④ B.①③ C.①②③ D.②③④
 Al2O3 ;此反应属于基本反应类型中的 化合 反应。
Al2O3 ;此反应属于基本反应类型中的 化合 反应。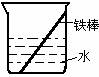 (2)如右图所示,将部分铁棒插入水中,部分露在干燥的空气中,试判断铁棒哪一部分生锈更快 ① (填序号)。
(2)如右图所示,将部分铁棒插入水中,部分露在干燥的空气中,试判断铁棒哪一部分生锈更快 ① (填序号)。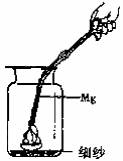 ②露在干燥的空气中那部分铁棒生锈更快
②露在干燥的空气中那部分铁棒生锈更快 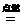 2CO2+3H20 2Mg+O2
2CO2+3H20 2Mg+O2 2Fe+3CO2 。
2Fe+3CO2 。