0 19205 19213 19219 19223 19229 19231 19235 19241 19243 19249 19255 19259 19261 19265 19271 19273 19279 19283 19285 19289 19291 19295 19297 19299 19300 19301 19303 19304 19305 19307 19309 19313 19315 19319 19321 19325 19331 19333 19339 19343 19345 19349 19355 19361 19363 19369 19373 19375 19381 19385 19391 19399 447348
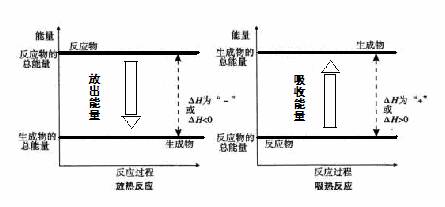
 根据上述内容回答下列问题
根据上述内容回答下列问题