网址:http://m.1010jiajiao.com/timu3_id_193028[举报]
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②该反应为______(填“吸热”或“放热”)反应.
③求实验2的平常常数K,要求写出计算过程,结果取二位小数
(2)已知在常温常压下:①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1)△H=-1451.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
写出甲醇不完全燃烧生成CO和液态水的热化学方程式______
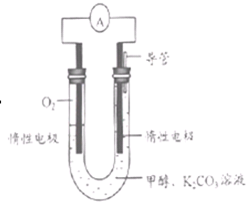
(3)甲醇和氧气完全燃烧的反应可以设计为燃料电池,装置如图,该电池通过K2CO3溶液吸收反应生的CO2.则负极的电极反应为______.
(4)CaCO3的KSP=2.8×10-9.将等体积CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需该CaCl2溶液的最小浓度为______.
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②该反应为______(填“吸热”或“放热”)反应.
③求实验2的平常常数K,要求写出计算过程,结果取二位小数
(2)已知在常温常压下:①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1)△H=-1451.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
写出甲醇不完全燃烧生成CO和液态水的热化学方程式______
(3)甲醇和氧气完全燃烧的反应可以设计为燃料电池,装置如图,该电池通过K2CO3溶液吸收反应生的CO2.则负极的电极反应为______.
(4)CaCO3的KSP=2.8×10-9.将等体积CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需该CaCl2溶液的最小浓度为______.
 查看习题详情和答案>>
查看习题详情和答案>>
 CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1中以v(CO2)表示的平均反应速率为 (第二位小数)。
②该反应为 (填“吸热”或“放热”)反应。
③求实验2的平常常数K,要求写出计算过程,结果取二位小数。
(2)已知在常温常压下:

写出甲醇不完全燃烧生成CO和液态水的热化学方程式 。
(3)甲醇和氧气完全燃烧的反应可以设计为燃料电池,装置如图,该电池通过K2CO3溶液吸收反应生的CO2。则负极的电极反应为 。

(4)CaCO3的KSP=2.8×10¯9。将等体积CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10¯4mol/L,则生成沉淀所需该CaCl2溶液的最小浓度为 。
某种优质燃料油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种.已知甲、乙及CO、H2的燃烧热如下:

取甲、乙按不同比例混合的燃油23 g,在足量的氧气中燃烧时,放出的热量Q与混合物中乙的质量分数x的关系如下图所示.试求:
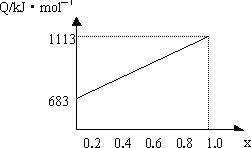
(1)乙的相对分子质量Mr=________.
(2)160 g由甲、乙以等物质的量混合而成的燃油在347.2 L O2中恰好完全燃烧,得492.8 L气体,冷却至室温时,还剩余224 L(气体体积均在标准状态下测定)气体.由此可求得混合物中C、H、O的原子个数比为________;甲、乙的分子式为:甲________;乙________.
(3)1 mol由甲、乙以等物质的量混合而成的燃油在一定量的氧气中燃烧,放出热量2876 kJ/mol,则反应中生成CO________mol.
已知常温下A、B及CO、H2的燃烧热如下:
1 mol物质 | A | B | CO | H2 |
燃烧热/kJ·mol-1 | 725 | 5518 | 283 | 286 |
A、B不同比例混合的燃料91.2 g,在足量的氧气中燃烧时,放出的热量Q与混合燃料中B的物质的量分数x的关系如下图。(计算过程中保留两位小数)
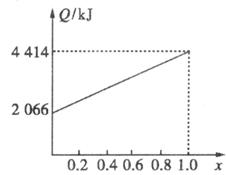
(1)相对分子质量A为_________,B为_________。
(2)73 g由A、B等物质的量混合而成的燃料在160 LO2中完全燃烧后,冷却后得到104 L气体,通过碱石灰充分吸收后剩余3.2 L(气体体积均在标准状况下测定)。由此可求得混合物中n(C):n(H):n(O)=_________,若A是醇,B为饱和烃,则A的分子式为_________,B分子式为_________。
(3)l mol由A、B等物质的量混合而成的燃料在一定量的氧气中燃烧,放出热量2 980 kJ,则反应中生成CO_________mol。
查看习题详情和答案>>