摘要:例1.已知破坏各1mol N≡N键.H-H键和N-H键分别需吸收的能量为946kJ.436kJ.391kJ.计算1molN2(g)和3molH2(g)完全转化为NH3(g)的反应热的理论值. [分析]N2(g)与H2(g)反应的化学方程式为N2(g)+3H2(g)=2NH3(g).使1mol的N≡N键断裂吸收946kJ的能量.使3molH-H键断裂共需吸收436kJ·mol-1×3mol=1308kJ的能量.因此使1molN2(g)和3molH2(g)反应物的化学键断裂共需吸收的能量为946kJ+1308kJ=2254 kJ.而2molNH3(g)中含6molN-H键.形成6molN-H键时放出能量为391 kJ·mol-1×6mol=2346 kJ .因此反应热应等于生成物分子形成时所释放的总能量2346kJ·mol-1与反应物分子断裂时所吸收的总能量2254 kJ·mol-1之差.即放出了92 kJ·mol-1的能量. 例2.下列对热化学方程式1/2H2(g)+ 1/2I2,△H = +26kJ·mol-1的叙述中.正确的是 ( ) A.1mol氢气和1mol碘蒸气完全反应需要吸收26kJ的热量 B.1个氢分子和1个碘分子完全反应需要吸收52kJ的热量 C.1molH2(g)与1molI2(g)完全反应生成2mol的HI气体需吸收52kJ的热量 D.1molH2(g)与1molI2(g)完全反应放出26kJ的热量 [分析]热化学方程式的具体形式是表示一定物质的量的.一定聚集状态的反应物完全反应生成一定聚集状态的生成物时的放热.吸热情况.只要依据书写热化学方程式的六点注意事项.对于本例题就不难作出判断.在A.B.D三个选项中均未指明生成物的状态,且D将反应错认为是放热反应,A则未将反应的化学计量数与△H正确对应起来,B则无视热化学方程式中各物质前的化学计量数不表示分子个数的前提.因此合理答案只有C. [随堂检学]1.以下反应属于吸热反应的是 ( ) A.生石灰加水制熟石灰 B.氢氧化钡晶体与氯化铵晶体混合 C.氢氧化钠溶液中滴加稀盐酸 D.化石燃料的燃烧
网址:http://m.1010jiajiao.com/timu3_id_193022[举报]
已知破坏各1mol N≡N键、H─H键、和N─H键需要吸收的能量分别为946kJ、436kJ、391kJ。计算1mol N2(g)和3mol H2(g)完全转化为NH3的反应热的理论值。
查看习题详情和答案>>
已知破坏各1mol N≡N键、H─H键、和N─H键需要吸收的能量分别为946kJ、436kJ、391kJ。计算1mol
N2(g)和3mol
H2(g)完全转化为NH3的反应热的理论值。
查看习题详情和答案>>
合成氨对工、农业生产和国防都有重要意义。已知:25℃时,N2(g)+3H2(g)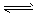 2NH3(g);△H<0,请回答:
2NH3(g);△H<0,请回答:
(1)已知:破坏1 mol N≡N键、H-H键和N-H键分别需要吸收的能量为946kJ、436kJ、391kJ。计算1mol
N2 (g) 和3 mol H2 (g) 完全转化为NH3(g)的反应热的理论值___________ 。
(2)对合成氨平衡体系改变以下条件,判断平衡移动方向:
I ①恒容容器中充入氦气,平衡________移动(填“正向”、“逆向”、“不移动”,下同);
②恒容容器中充入氮气,平衡________移动;
③恒容容器中充入氨气,平衡________移动;
II 恒压容器内充入氦气,平衡________移动。
(3)在密闭容器中,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是_________ 。
a 平衡不发生移动
b 平衡向正反应方向移动
c 平衡向逆反应方向移动
d.NH3的质量分数增加
e 正、逆反应速率都增大
(4)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是________(填序号)。
① 20 MPa -5 0 MPa
②500℃的高温
③铁触媒作催化剂
④ 将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中
查看习题详情和答案>>
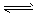 2NH3(g);△H<0,请回答:
2NH3(g);△H<0,请回答:(1)已知:破坏1 mol N≡N键、H-H键和N-H键分别需要吸收的能量为946kJ、436kJ、391kJ。计算1mol
N2 (g) 和3 mol H2 (g) 完全转化为NH3(g)的反应热的理论值___________ 。
(2)对合成氨平衡体系改变以下条件,判断平衡移动方向:
I ①恒容容器中充入氦气,平衡________移动(填“正向”、“逆向”、“不移动”,下同);
②恒容容器中充入氮气,平衡________移动;
③恒容容器中充入氨气,平衡________移动;
II 恒压容器内充入氦气,平衡________移动。
(3)在密闭容器中,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是_________ 。
a 平衡不发生移动
b 平衡向正反应方向移动
c 平衡向逆反应方向移动
d.NH3的质量分数增加
e 正、逆反应速率都增大
(4)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是________(填序号)。
① 20 MPa -5 0 MPa
②500℃的高温
③铁触媒作催化剂
④ 将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中