20.(8分)下表是三个不同短周期部分元素的原子半径及主要化合价:
|
元素代号 |
W |
R |
X |
Y |
Z |
|
原子半径/nm |
0.037 |
0.157 |
0.066 |
0.070 |
0.077 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2、+4 |
试回答下列问题:
⑴五种元素中原子半径最大的元素在周期表中位于 。
⑵写出下列有关反应的化学方程式:
①Z的单质与Y元素的最高价氧化物对应的水化物反应:
;
②R2X2与ZX2反应:
。
⑶X可与Z形成一种有恶臭味的气体,该气体与氧气发生反应的物质的量之比为1:2,且反应前后气体的总体积不变,试写出该气体分子(分子中各原子最外层均满足8e-结构,且含有非极性键)的电子式 。
17.(14分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
⑴一般地,同一主族的元素最外层电子数相同,其单质及其对应的化合物具有相似的性质。下列关于同主族元素所形成物质的推理中不正确的是 ;
A.Na与Cl2反应能形成离子键,故K与Cl2反应也能形成离子键
B.Cl2能置换出NaBr溶液中的溴,故Br2能置换出NaI溶液中的碘
C.Li在氧气中燃烧生成Li2O,故Na在氧气中燃烧生成Na2O
D.C在自然界有稳定的单质存在,故Si在自然界也有稳定的单质存在
E.所有主族元素的原子形成简单阳离子时的正价数都与它的族序数相等
⑵表中N元素形成的单质的电子式为 ;
As的原子结构示意图是 ;
|
|
|
||||
|
|
C |
N |
O |
F |
|
|
|
Si |
P |
S |
Cl |
|
|
|
Ge |
As |
Se |
Br |
|
|
|
Sn |
Sb |
Te |
I |
|
|
|
Pb |
Bi |
Po |
At |
|
⑶根据元素周期律,请你预测:
H3AsO4、H3PO4的酸性强弱 > ; As、Se气态氢化物的稳定性 > ;
⑷现有某非金属元素R,若其原子最外层电子数为x,写出R形成的简单阴离子的化学式 ;
⑸在一定的条件下,S与H2反应有一定的限度(可理解为反应进行的程度),请判断在相同的条件下Se与H2反应的限度(选填“更大”、“更小”或“相同”) 。
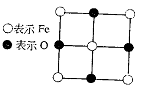 (2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中Fe2+所占分数(用小数表示,精确到0.001)为多少?
(2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中Fe2+所占分数(用小数表示,精确到0.001)为多少?
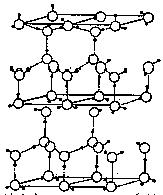 (10分)水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键相互连接成庞大的分子晶体,其结构示意图如图所示
(10分)水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键相互连接成庞大的分子晶体,其结构示意图如图所示