(友情提示:读懂题目再动手,中间不能少步骤!)
17、某样品为Cu和CuO的混合物。为测定样品中含CuO的质量分数,甲、乙、丙、丁四位同学用相同的样品进行实验,测定数据如下表。请分析实验数据进行有关计算:
|
|
甲 |
乙 |
丙 |
丁 |
|
取用固体样品质量/克 |
30 |
25 |
20 |
20 |
|
加入硫酸溶液质量/克 |
100 |
100 |
100 |
120 |
|
剩余固体质量/克 |
22 |
17 |
12 |
12 |
⑴.混合物中含氧化铜的质量分数。
⑵.硫酸溶液中含H2SO4的质量分数。
16、(8分)实验室有甲、乙、丙三瓶溶液,分别含有下列六种物质中的两种:KOH、HNO3、AgNO3、KCl、K2SO4、Ba(NO3)2。经初步分析情况如下:
|
溶液 |
溶液外观 |
溶液pH |
溶液成分 |
|
甲 |
无色、透明 |
> |
? |
|
乙 |
无色、透明 |
= |
Ba(NO3)2 |
|
丙 |
无色、透明 |
< |
? |
为了进一步确定溶液的组成,进行如下图所示实验。已知溶液中不可能同时存在Ag+和OH-,且两次混合均完全反应。根据上述信息回答下列问题:
乙溶液 丙溶液 沉淀物X 甲溶液 沉淀物Y

⑴.甲溶液中肯定含有的物质是 (填化学式,下同),含有的另一种物质是 ,
据此推断,沉淀X是 。
⑵.根据(I)的判断,混合(II)发生反应的化学方程式为 ,
。
⑶.溶液M中的溶质可用作复合肥料,它的化学式是 。
14、(11分)某校化学兴趣小组的同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体。但他们在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体。请你和他们一起探究并回答有关问题:
[提出问题]:为什么会生成淡黄色色固体?
[查阅资料]:他们查阅资料,记录了下列几种物质的颜色:
|
物质 |
MgO |
MgCl2 |
Mg3N2 |
Mg(NO3)2 |
MgCO3 |
Mg(OH)2 |
|
颜色 |
白色 |
白色 |
淡黄色 |
白色 |
白色 |
白色 |
有些同学认为不必查阅氯化镁的颜色,理由是 。
[猜想假设]:分析资料,小明认为淡黄色固体可能是镁与空气中的 反应生成的。
[实验探究]:小明同学设计实验证实了自己的猜想。具体做法是:称取两份质量相同的镁,一份在氧
气中完全燃烧,另一份在空气中完全燃烧,称其生成物质量。写出实验中涉及的两个反应化学方程式: ① ; ② 。
[实验结论]:实验中发现,镁在氧气中燃烧生成固体质量大于镁在空气中燃烧生成固体质量。通过探究证明小明的猜想是正确的。
[反思评价]:实验后小欣同学想起,镁条在空气中燃烧时,除生成白色固体还看到有少量黑烟。你猜测可能是空气中的 气体也参加了反应。通过该探究实验,你对燃烧有什么新认识?请回答两点。① ;② 。



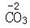 。
。