24. (6分)小明在检测发酵粉(如图)中小苏打的含量时。取20g发酵粉放入烧杯中.向其中滴加46g稀盐酸时恰好不产生气泡(假设发酵粉中其它成分不反应也不溶于水).测得杯中的混合液61.6g,试回答:
(6分)小明在检测发酵粉(如图)中小苏打的含量时。取20g发酵粉放入烧杯中.向其中滴加46g稀盐酸时恰好不产生气泡(假设发酵粉中其它成分不反应也不溶于水).测得杯中的混合液61.6g,试回答:
(1)写出上述化学反应方程式 ______________________________
(2)计算发酵粉中小苏打的质量分数;
|
(3)过滤烧杯中61.6g混合液,所得滤液中溶质的质量分数?
|
23.(8分)晓明同学在实验室做实验时,不小心将酚酞试液滴入了盛有碳酸钾溶液的试管中,意外地发现溶液的颜色变红了,他联想到刚学过的碳酸钠溶液也能使酚酞试液变红,于是他进行了下列探究。
实验一:重复进行上述实验,用一洁净的试管取少量纯净的碳酸钾溶液,滴加酚酞试液,酚酞试液变红;用pH试纸测试,该溶液的pH为11。
[提出问题]碳酸钾、碳酸钠都属于“盐”类,你认为晓明最想探究的问题是 ;
[假设猜想]实验开始出现的现象,你对溶液变红的原因有哪些猜测:
猜测一: ;
猜测二: ;
猜测三: ;
(1)、晓明进行实验一的目的是 ;
(2)、由实验一得出的结论是 ;
[实验验证]晓明同学为了证明自己的猜想,又进行了下列实验。
实验二:分别测试纯净的碳酸钠、氯化钠、硫酸铜、硫酸钠、氯化铁、硝酸钾溶液的pH,其结果纪录如下
|
盐 |
Na2CO3 |
NaCl |
CuSO4 |
Na2SO4 |
FeCl3 |
KNO3 |
|
pH |
10 |
7 |
4 |
7 |
3 |
7 |
(3)、由实验二得出的结论是
。
[结论与解释]通过晓明的实验探究,你认为开始的实验现象解释的原因是
。
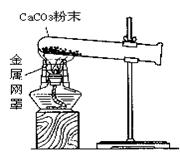
21、(7分)某化学实验小组在实验室用下图装置做CaCO3受热分解的实验。加热一段时间后,同学们对试管内剩余固体的成分进行探究。请你参与探究。
[提出问题]加热CaCO3后残留的固体成分是什么?
[作出猜想]
|
 猜想1:CaCO3完全分解,固体成分为 CaO,则反应方程式
猜想1:CaCO3完全分解,固体成分为 CaO,则反应方程式
为 ;
猜想2:CaCO3未完全分解,固体成分为CaO、CaCO3;
猜想3:CaCO3未分解,固体成分为CaCO3。
[实验与事实]
(1)甲同学取少量残留固体于试管中,加适量水振荡后静置,再滴几滴无色酚酞试液,溶液变红。
(2)乙同学取少量残留固体于试管中,先加适量水振荡后静置,再滴几滴无色酚酞试液,溶液变红。接着加过量稀盐酸,有气泡生成,该反应的化学方程式是 。反应过程中固体逐渐消失。你认为还应该看到的现象是 。
[结论与交流]
甲同学认为猜想1成立,他的结论是 (填“合理”或“不合理”)的。你认为猜想 成立。
[拓展与迁移]
(1)酒精灯放置金属网罩的目的是 。
(2)若给上图实验装置增加下列仪器中的 (填序号),就可以直接根据实验现象判断CaCO3是否分解。

|
|
|
① ② ③ ④
|
|
|
|
|
|
|
|
|
(2)(2分)写出A操作过程中涉及的反应的化学方程式
。
|
17.(7分)“更高、更快、更强”的奥运精神在化学学习中有所体现。请分析题意,按要求回答问题:
(1)写出右下图实验一中“更高”的化学方程式:
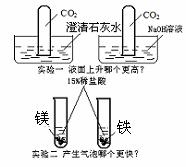 由此实验你认为实验室除去混合气体中的二氧化碳气体杂质的最佳试剂是 ;理由是:
由此实验你认为实验室除去混合气体中的二氧化碳气体杂质的最佳试剂是 ;理由是:
。
(2)写出右图实验二中“更快”的化学方程式:
造成两者反应速度快慢不同的因素是
。
(3)“更强”,辩论见风采。某学校化学兴趣小组的同学准备了一场辩论赛。辩论主题是“1 + 1等于不等于2。”甲方认为:1 + 1等于2。乙方认为:1 + 1不等于2。请根据溶液的相关知识判断。
①如果你认为甲方正确,请举一例 ;
②如果你认为乙方正确,请举一例 。
|
①将少量粉末放在烧杯中,加足量水,搅拌、静置、过滤,得无色溶液及白色沉淀;②向过滤所得沉淀中加足量稀硝酸,沉淀全部溶解且无气体产生;③向滤液中滴加硝酸银溶液,有白色沉淀生成再加稀硝酸,沉淀不溶解.根据以上实验现象推断,白色粉末中
一定存在___ _;一定不存在_ ___;可能存在___ _.(填写化学式)
 [提出问题]各化工厂排放废水中主要成分是什么?
[提出问题]各化工厂排放废水中主要成分是什么?