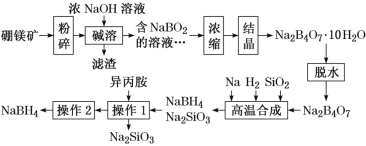
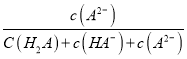【题目】氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义。
Ⅰ.一定条件下(T ℃、1.01×105 Pa),可以用Cl2(g)和NH3(g)制得NH2Cl(g),同时得到HCl(g)。已知部分化学键的键能如下表:
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/kJ/mol | 391.3 | 243.0 | 191.2 | 431.8 |
写出该反应的热化学方程式:___________________________________________。
Ⅱ.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g) ![]() 2NOCl(g) ΔH<0。保持恒温恒容条件,将物质的量之和为3 mol的NO和Cl2以不同的氮氯比
2NOCl(g) ΔH<0。保持恒温恒容条件,将物质的量之和为3 mol的NO和Cl2以不同的氮氯比![]() 进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
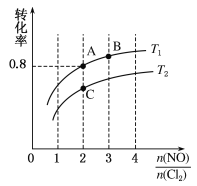
(1)图中T1、T2的关系为T1________T2(填“>”“<”或“=”)。
(2)图中纵坐标为物质________的转化率,理由为_________________________________。
(3)图中A、B、C三点对应的NOCl体积分数最大的是________(填“A”“B”或“C”)。
(4)若容器容积为1 L,经过10min到达A点,该时间段内化学反应速率υ(NO)=_________。B点的平衡常数为________。
(5)若在温度为T1,容积为1 L的容器中,充入0.5mol NO、1mol Cl2、2mol NOCl,υ(正)_____υ(逆) (填“<”“>”或“=”),理由为________________________________