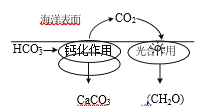
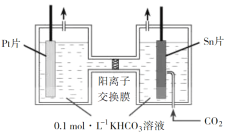
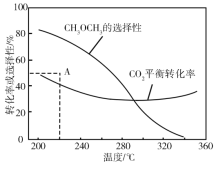
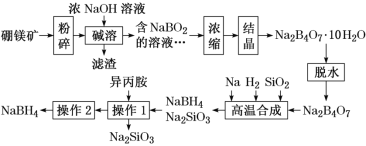
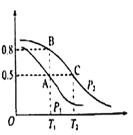
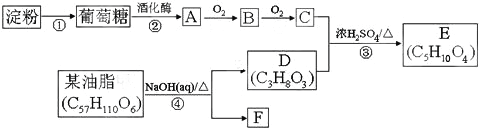
题目内容
【题目】氨气是极易溶于水的气体,常温常压下,1体积水大约能溶解700体积的氨气。
(1)实验室可在浓氨水中加入固体NaOH快速制取氨气,请用化学平衡移动原理简述原因_______________________________________________________________。
(2)甲、乙两瓶氨水的浓度分别为1mol·L-1和0.1mol·L-1,则甲、乙两瓶氨水中c(OH-)之比________(填“>”、“<”或“=”)10。
(3)向10mL0.1 mol/L的氨水中逐滴加入20mL 0.1 mol/L的醋酸,溶液导电性的变化是__________________(填“增大”、“减小”或“不变”)。写出二者反应的离子方程式:_______________________________________________。
【答案】在浓氨水中存在NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,当加入固体NaOH后,c(OH-)变大,同时溶液温度升高,都促使平衡逆向移动 < 先增强后减弱 NH3·H2O+CH3COOH== NH4++CH3COO-+H2O
NH4++OH-,当加入固体NaOH后,c(OH-)变大,同时溶液温度升高,都促使平衡逆向移动 < 先增强后减弱 NH3·H2O+CH3COOH== NH4++CH3COO-+H2O
【解析】
(1)、在浓氨水中存在NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,当加入固体NaOH后,c(OH-)变大,同时溶液温度升高,都促使平衡逆向移动,所以实验室可在浓氨水中加入固体NaOH快速制取氨气,故答案为在浓氨水中存在NH3+H2O
NH4++OH-,当加入固体NaOH后,c(OH-)变大,同时溶液温度升高,都促使平衡逆向移动,所以实验室可在浓氨水中加入固体NaOH快速制取氨气,故答案为在浓氨水中存在NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,当加入固体NaOH后,c(OH-)变大,同时溶液温度升高,都促使平衡逆向移动;
NH4++OH-,当加入固体NaOH后,c(OH-)变大,同时溶液温度升高,都促使平衡逆向移动;
(2)、甲瓶氨水的浓度是乙瓶氨水浓度的10倍,故甲瓶氨水的电离程度比乙瓶氨水的电离程度小,所以甲、乙两瓶氨水中c(OH-)之比小于10。故答案为:<;
(3)、氨水为弱电解质,开始导电性不强,滴入醋酸,反应生成醋酸铵,为强电解质,离子浓度增大,导电性增强,反应完全后,继续滴入醋酸,溶液体积变大,离子浓度减小,导电性又逐渐减弱,故答案为:先增强后减弱, NH3·H2O+CH3COOH== NH4++CH3COO-+H2O。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案【题目】25 ℃下,部分弱酸的电离常数如表。下列有关说法正确的是
弱酸 | HCOOH | HClO | H2S |
电离平衡 常数(Ka) | Ka=1.0×10-4 | Ka=2.0×10-8 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
A.相同浓度的HCOOH和HClO溶液的pH后者小
B.若HCOONa和HCOOH的混合溶液的pH=3,则![]() =10
=10
C.任何浓度NaHS溶液中总存在:c(Na+)+c(H+)=c(OH-)+c(HS-)
D.向NaClO溶液中通入H2S发生的反应为2ClO-+H2S===S2-+2HClO