题目内容
【题目】Na2O2是重要的化工原料,具有多种用途。
(1)Na2O2具有氧化性,可以将SO2氧化为硫酸钠,写出该反应的化学方程式:___,该反应中,Na2O2的作用为___(填“还原剂”、“氧化剂”或“既是氧化剂又是还原剂”)。
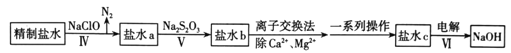
(2)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选择适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可作供氧剂。
装置A是CO2气体的发生装置,请写出仪器a的名称___,B中盛饱和NaHCO3溶液,其作用是___。写出C中过氧化钠与二氧化碳反应的化学方程式___。D中盛放的试剂可以是____(填序号)。
①浓H2SO4 ②NaOH溶液 ③CaCl2溶液 ④Na2SO3溶液
(3)将一定量的Na2O2固体投入到含有下列离子的溶液中:NO3-、HCO3-、CO32-、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)___(填离子符号)。
【答案】Na2O2+SO2=Na2SO4 氧化剂 分液漏斗 除去CO2中的HCl气体 2Na2O2+2CO2=2Na2CO3+O2 ② NO3-
【解析】
(1)Na2O2具有氧化性,化合价降低;
(2)根据装置特点,仪器a为分液漏斗;B中盛饱和NaHCO3溶液,可用吸收挥发出的HCl气体,并能降低二氧化碳的溶解度;过氧化钠与二氧化碳反应生成碳酸钠和氧气;装置D中装有吸收未反应的二氧化碳的试剂;
(3)Na2O2固体投入溶液中,与水反应生成NaOH。
(1)Na2O2具有氧化性,可以将SO2氧化为硫酸钠,方程式为Na2O2+SO2=Na2SO4;Na2O2的化合价降低,作氧化剂;
(2)根据装置特点,仪器a为分液漏斗;B中盛饱和NaHCO3溶液,可用吸收挥发出的HCl气体,并能降低二氧化碳的溶解度;过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式为2Na2O2+2CO2=2Na2CO3+O2;装置D中装有吸收未反应的二氧化碳的试剂,则为NaOH溶液,答案为②;
(3)Na2O2固体投入溶液中,与水反应生成NaOH,则溶液中的Na+增大,与HCO3-反应生成CO32-,则HCO3-减少,CO32-增大,而NO3-未变。

 导学全程练创优训练系列答案
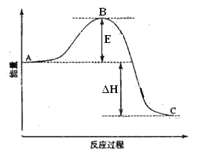
导学全程练创优训练系列答案【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3
回答下列问题:已知反应①中的相关的化学键键能数据如表:
化学键 | H—H | C—O |
| H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(1)由此计算ΔH1=__kJ·mol-1,已知ΔH2=-58kJ·mol-1,则ΔH3=__kJ·mol-1。
(2)在一定条件下,向2L恒容密闭容器中冲入1molCO2和3molH2发生反应②,5min时测得生成了0.4molH2O,求5min的反应速率v(H2)=__,写出一种能加快反应速率的措施___
(3)甲醇是电动汽车的理想燃料,工作原理如图所示:
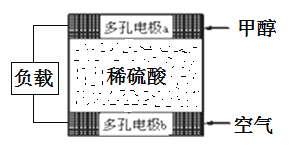
多孔电极b为燃料电池的__极(填“正”或“负”),多孔电极a发生的电极反应式为:____
【题目】下表是一些烷烃的燃烧热,则下列表达正确的是
化合物 | 燃烧热/ kJ·mol-1 | 化合物 | 燃烧热/ kJ·mol-1 |
甲烷 | 891.0 | 正丁烷 | 2878.0 |
乙烷 | 1560.8 | 异丁烷 | 2869.6 |
丙烷 | 2221.5 | 异戊烷 | 3531.3 |
A. 正戊烷的燃烧热大于3531.3 kJ·mol-1
B. 相同质量的烷烃、碳的质量分数越大,燃烧放出的热量越多
C. 正丁烷转化为异丁烷的热化学方程式为:CH3CH2CH2CH3(g) ![]() CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
D. 甲烷燃烧的热化学方程式为:CH4(g)+2O2(g) ![]() CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
【题目】中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如下图所示。

(1)根据上图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的_________,
a.SO2 b.NOx c.VOCs d. NH3
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式_______。

(3)SO2是气体污染物的主要成分之一。作为一种化学性质活泼的物质,它能发生多种反应,请按照下表提示,从不同角度梳理SO2不同类的化学性质,将化学方程式填在下表中。
SO2性质梳理 | 化学方程式 | |
物质类别 | 酸性氧化物 | ①SO2 +H2O |
②SO2 + CaO = CaSO3 | ||
③_______________________ | ||
S元素 价态 | S为+4价 | ①_______________________ |
② SO2 + 2H2S = 3S + 2H2O | ||
(4)科学家经过研究发现中国霾呈中性,其主要原因如图所示:

请判断A的化学式并说明判断理由:______________________。