题目内容
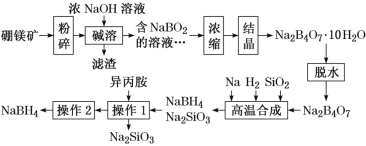
【题目】硼氢化钠(NaBH4)广泛用于化工生产,常温下能与水反应,易溶于异丙胺(沸点为33 ℃)。工业上可用硼镁矿(主要成分为Mg2B2O5·H2O,含少量杂质Fe3O4)制取NaBH4,其工艺流程如下:
回答下列问题:
(1)NaBH4中氢元素的化合价为_______。
(2)碱溶时Mg2B2O5发生反应的化学方程式是________。
(3)滤渣的主要成分是_____。
(4)高温合成中,加料之前需将反应器加热至100 ℃以上,并通入氩气。通入氩气的目的是_____。
(5)操作2的名称为______,流程中可循环利用的物质是_____。
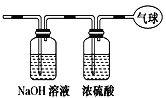
(6)在碱性条件下,用惰性电极电解NaBO2溶液也可制得NaBH4,装置如图所示,电解总反应的离子方程式为_______。

(7)NaBH4常用作还原剂,H2也是常见的还原剂。与相同氧化剂反应时,1 g NaBH4的还原能力相当于_____g H2的还原能力(结果保留两位小数)。
【答案】-1 Mg2B2O5+2NaOH+H2O = 2NaBO2+2Mg(OH)2或Mg2B2O5·H2O+2NaOH = 2NaBO2+2Mg(OH)2 Fe3O4和Mg(OH)2 排除装置中的水蒸气和空气 蒸馏 异丙胺 ![]() +2H2O
+2H2O![]()
![]() +2O2↑ 0.21
+2O2↑ 0.21
【解析】
硼镁矿(主要成分为Mg2B2O5·H2O,含少量杂质Fe3O4)中的Fe3O4不能溶于NaOH,过滤后形成滤渣,得到的NaBO2溶于经过浓缩结晶得到Na2B4O7·10H2O,脱水后生成Na2B4O7,Na2B4O7在钠和氢气条件下与二氧化硅反应生成NaBH4和硅酸钠,用异丙胺溶解生成的NaBH4,除去硅酸钠,如何通过蒸馏分离得到NaBH4,据此分析解答。
(1)NaBH4中Na为+1价、B为+3价,根据化合物中各元素正负化合价代数和为0,计算出H为-1价,故答案为:-1价;
(2)碱溶时Mg2B2O5发生反应的化学方程式为Mg2B2O5+2NaOH+H2O = 2NaBO2+2Mg(OH)2,故答案为:Mg2B2O5+2NaOH+H2O = 2NaBO2+2Mg(OH)2;
(3)根据上述分析,滤渣的主要成分是Fe3O4和Mg(OH)2,故答案为:Fe3O4和Mg(OH)2;
(4)反应加料之前,需要将反应容器加热至100℃以上并通入氩气,氩气可以排出反应器中的水蒸气和空气,防止氢气和钠以及生产的硼氢化钠(NaBH4)与氧气和水反应,故答案为:排出反应器中的水蒸气和空气;
(5)操作1得到的物质是硼氢化钠和异丙胺的混合物,异丙胺的沸点为33 ℃,较低,易挥发,可以通过蒸馏操作分离二者,因此操作2为蒸馏,分离得到的异丙胺可循环利用,故答案为:蒸馏;异丙胺;
(6)在碱性条件下,用惰性电极电解NaBO2溶液也可制得NaBH4,根据图示,NaBO2在阴极发生还原反应生成![]() ,阳极上水发生氧化反应放出氧气,电解的总反应的离子方程式为
,阳极上水发生氧化反应放出氧气,电解的总反应的离子方程式为![]() +2H2O
+2H2O![]()
![]() +2O2↑,故答案为:
+2O2↑,故答案为:![]() +2H2O
+2H2O![]()
![]() +2O2↑;
+2O2↑;
(7) NaBH4中H为-1价,做还原剂时,H从-1价升高为+1价,1molNaBH4转移电子数为4×2=8mol,即38g NaBH4转移8mol电子,则1 g NaBH4转移电子数为8mol×![]() =
=![]() mol,H2做还原剂,1molH2失去电子2mol,则转移
mol,H2做还原剂,1molH2失去电子2mol,则转移![]() mol电子需要氢气
mol电子需要氢气![]() mol,质量为
mol,质量为![]() mol×2g/mol=0.21g,故答案为:0.21。
mol×2g/mol=0.21g,故答案为:0.21。

【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25 ℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D. 80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L