��Ŀ����
����Ŀ�����Ļ������ڹ�ҵ�����������ж�����Ҫ��Ӧ�ã����û�ѧԭ���о����ĵ��ʼ��仯���������Ҫ���塣
��.һ��������(T ����1.01��105 Pa)��������Cl2(g)��NH3(g)�Ƶ�NH2Cl(g)��ͬʱ�õ�HCl(g)����֪���ֻ�ѧ���ļ������±���
��ѧ�� | N-H | Cl-Cl | N-Cl | H-Cl |
����/kJ/mol | 391.3 | 243.0 | 191.2 | 431.8 |
д���÷�Ӧ���Ȼ�ѧ����ʽ��___________________________________________��
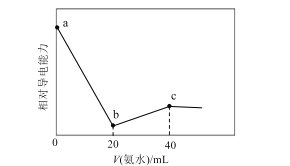
��.��������(NOCl)���л��ϳ��е���Ҫ�Լ�������NO��Cl2��һ�������ºϳɣ�2NO(g)��Cl2(g) ![]() 2NOCl(g)����H<0�����ֺ��º��������������ʵ���֮��Ϊ3 mol��NO��Cl2�Բ�ͬ�ĵ��ȱ�
2NOCl(g)����H<0�����ֺ��º��������������ʵ���֮��Ϊ3 mol��NO��Cl2�Բ�ͬ�ĵ��ȱ�![]() ���з�Ӧ��ƽ��ʱij��Ӧ���ת�����뵪�ȱȼ���ͬ�¶ȵĹ�ϵ��ͼ��ʾ��
���з�Ӧ��ƽ��ʱij��Ӧ���ת�����뵪�ȱȼ���ͬ�¶ȵĹ�ϵ��ͼ��ʾ��
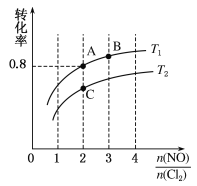
��1��ͼ��T1��T2�Ĺ�ϵΪT1________T2(����>����<����������)��
��2��ͼ��������Ϊ����________��ת���ʣ�����Ϊ_________________________________��
��3��ͼ��A��B��C�����Ӧ��NOCl�������������________(����A����B������C��)��
��4���������ݻ�Ϊ1 L������10min����A�㣬��ʱ����ڻ�ѧ��Ӧ������(NO)=_________��B���ƽ�ⳣ��Ϊ________��
��5�������¶�ΪT1���ݻ�Ϊ1 L�������У�����0.5mol NO��1mol Cl2��2mol NOCl����(��)_____��(��) (����������������������)������Ϊ________________________________
���𰸡�Cl2(g)��NH3(g)===NH2Cl(g)��HCl(g)����H����11.3 kJ��mol��1 < Cl2 ![]() ����ʱ��Cl2��ת�������� A 0.16 mol/(L��min) 80 > Qc<K��Ӧ������У�v(��)��v(��)
����ʱ��Cl2��ת�������� A 0.16 mol/(L��min) 80 > Qc<K��Ӧ������У�v(��)��v(��)
��������
���Ȱ�(NH2C1)Ϊ���ۻ����NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)��H=��Ӧ��ļ���֮��-������ļ���֮�ͣ�
II(1)��2NO(g)+Cl2(g)=2NOCl(g) ��H<0����ӦΪ���ȷ�Ӧ������ƽ��������У����ͼ��仯�����жϣ�
(2)��NO��Cl2�Բ�ͬ�ĵ��ȱȷ�Ӧ��ͼ����ת�������ֵ������������ַ�Ӧ������һ�ֻ������һ�ֵ�ת���ʣ�
(3)������ʽ��NO��Cl2���ķ�Ӧ��Ϊ2:1�����մ˷�Ӧ�ȣ�����ת�������ʱ�õ����������������
(4)��������м�����ʽ����A��ƽ�ⳣ�����¶Ȳ���ƽ�ⳣ�����䣬������=![]() �������ʣ�
�������ʣ�
(5)������Ũ�Ȼ���ƽ�ⳣ�����Ƚϣ��Ӷ��жϷ�Ӧ���еķ�����
��NH3(g)+Cl2(g)=NH2C1+HCl(g)����H=��Ӧ��ļ���֮��-������ļ���֮��= (3��391.3+243.0)-(2��391.3+191.2)=+11.3kJ.mol-1���Ȼ�ѧ����ʽΪCl2(g)��NH3(g)===NH2Cl(g)��HCl(g)��H����11.3kJ��mol��1���ʴ�Ϊ��Cl2(g)��NH3(g)===NH2Cl(g)��HCl(g)����H����11.3 kJ��mol��1��
��(1)��2NO(g)+Cl2(g)=2NOCl(g)��H<0����ӦΪ���ȷ�Ӧ������ƽ��������У�һ�����ȱ������£�����ƽ��������У���Ӧ��ƽ��ת���ʼ�С����T1<T2���ʴ�Ϊ��<��
(2)�����ֺ��º��������������ʵ���֮��Ϊ3mol��NO��Cl2�Բ�ͬ�ĵ��ȱȽ��з�Ӧ��ƽ��ʱij��Ӧ���ת�����뵪�ȱȼ���ͬ�¶ȵĹ�ϵ��ͼ��ʾ�����ȱ�Խ��ת����Խ��˵�������ʾ����������ת���ʣ��ʴ�Ϊ��Cl2��![]() ����ʱ��Cl2��ת��������
����ʱ��Cl2��ת��������
(3)������ʽ��NO��Cl2���ķ�Ӧ��Ϊ2:1�����մ˷�Ӧ�ȣ�����ת�������ʱ�õ����������������ͼ��A��B��C�����Ӧ��NOCl������������ǣ�A���ʴ�Ϊ��A��
(4)��2NO(g)+Cl2(g)=2NOCl(g)��H<0�����ֺ��º��������������ʵ���֮��Ϊ3mol��NO��Cl2�Բ�ͬ�ĵ��ȱȽ��з�Ӧ��A������ת����Ϊ0.8��![]() =2�����Ϊ1L��������м�����ʽ���㣬
=2�����Ϊ1L��������м�����ʽ���㣬
2NO(g)+Cl2(g)=2NOCl(g)
��ʼ��(mol/L) 2 1 0
�仯��(mol/L) 1.6 0.8 1.6
ƽ����(mol/L) 0.4 0.2 1.6
����(NO)=![]() =0.16 mol/(L��min)��
=0.16 mol/(L��min)��
A��ƽ�ⳣ��K=![]() =80���¶Ȳ���ƽ�ⳣ�����䣬��B��ƽ�ⳣ��Ϊ80��
=80���¶Ȳ���ƽ�ⳣ�����䣬��B��ƽ�ⳣ��Ϊ80��
�ʴ�Ϊ��0.16 mol/(L��min)��80��
(5)����ʱŨ�Ȼ�![]() ����ƽ�������ƶ���������(��)>��(��)���ʴ�Ϊ��>��Qc<K��Ӧ������С�
����ƽ�������ƶ���������(��)>��(��)���ʴ�Ϊ��>��Qc<K��Ӧ������С�

 Ӣ��СӢ������Ĭдϵ�д�
Ӣ��СӢ������Ĭдϵ�д� �����ҵ���������ͯ������ϵ�д�
�����ҵ���������ͯ������ϵ�д�