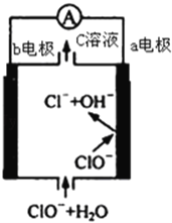
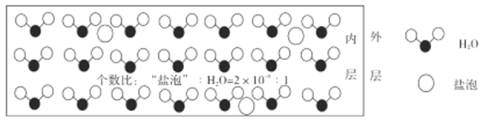
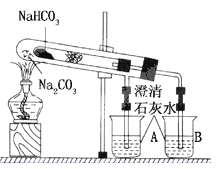
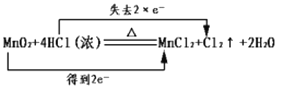
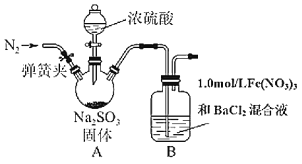
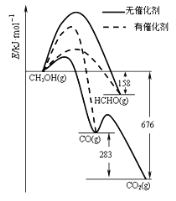
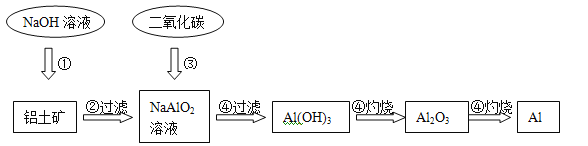
题目内容
【题目】将含amol金属钠和bmol金属铝的合金投入mg足量水中,完全溶解,无金属剩余,所得溶液密度为dgcm﹣3,下列相关计算式子中错误的是( )
A.NaOH的物质的量:(a﹣b)mol
B.NaAlO2的物质的量浓度:![]() mol/L
mol/L
C.标况下生成H2的体积:![]() L
L
D.参加反应的水的质量:18(a+1.5b)g
【答案】D
【解析】
发生反应:2Na+2H2O═2NaOH+H2↑和2Al+2NaOH+2H2O=2NaAlO2+3H2↑,所得溶液转化溶质为NaAlO2或者为NaOH、NaAlO2。
A.由Al原子守恒,可知n(NaAlO2)=n(Al)=bmol,由Na原子守恒可知:n(NaOH)=n(Na)﹣n(NaAlO2)=(a﹣b)mol,故A正确;
B.根据电子转移守恒,可知n(H2)=![]() =(0.5a+1.5b)mol,故溶液质量=(23a+27b+m)g﹣(0.5a+1.5b)mol×2g/mol=(22a+24b+m)g,溶液的体积为(22a+24b+m)g÷1000d/L=
=(0.5a+1.5b)mol,故溶液质量=(23a+27b+m)g﹣(0.5a+1.5b)mol×2g/mol=(22a+24b+m)g,溶液的体积为(22a+24b+m)g÷1000d/L=![]() L,故c(NaAlO2)=bmol÷
L,故c(NaAlO2)=bmol÷![]() L=
L=![]() mol/L,故B正确;
mol/L,故B正确;
C.标况下生成氢气的体积为:(0.5a+1.5b)mol×22.4L/mol=![]() L,故C正确;
L,故C正确;
D.由方程式可知,参加反应的水的物质的量为(a+b)mol,故参加反应的水为18(a+b)g,故D错误。
故选:D。

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目