题目内容
15.工业生产硝酸的尾气中含有氮氧化物NOx(假设仅为NO和NO2的混合物),影响生态环境.Ⅰ.氮氧化物NOx对环境主要影响有两点酸雨、光化学烟雾.
Ⅱ.工业上可用氨催化吸收法处理NOx,反应原理为:NH3+NOx$\stackrel{催化剂}{→}$N2+H2O
某化学兴趣小组模拟该处理过程的实验装置如图.
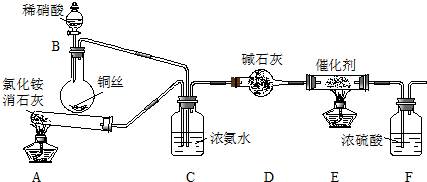
(1)装置A中发生的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)装置C的作用有两个:一个作用是通过气泡产生的速率来控制反应物的比例,另一个作用是使氨气和一氧化氮混合均匀,装置F的作用是吸收尾气.
(3)反应6NO2+8NH3$?_{加热}^{催化剂}$7N2+12H2O可用于处理NO2,当转移3.6mol电子时,消耗NO2的物质的量为0.9mol.
Ⅲ.工业上也常用NaOH溶液吸收法处理NOx:
NO+NO2+2NaOH=2NaNO2+H2O(Ⅰ)
2NO2+2NaOH=NaNO2+NaNO3+H2O(Ⅱ)
(1)当NOx被NaOH溶液完全吸收时,转化为盐,x的值可能是CD(填字母).
A.1.0 B.1.3 C.1.5 D.2.0
(2)2240mL(标准状况)NO和NO2的混合气体溶于200mLNaOH溶液中,恰好完全反应,并无气体放出,则NaOH溶液物质的量浓度是0.5mol/L.
Ⅳ.除能防止有毒气体的污染外,NaOH溶液吸收法还具有的优点是操作简便,产物为盐,可回收作氮肥,其缺点是不经济.
分析 Ⅰ.酸雨是指PH<5.6的雨水,氮氧化物NOx可形成硝酸型酸雨;光化学污染是氮的氧化物和有机烃类在光作用下的一系列复杂变化,光化学污染与氮的氧化物有关;
Ⅱ.A装置:制取氨气,B装置:制取一氧化氮,C装置:一个作用是通过气泡产生的速率来控制反应物的比例,使氨气和一氧化氮混合均匀,c中挥发的氨气含有水蒸气,进入E加热前应进行干燥,D装置:干燥混合气体,E装置:2NH3+2NO$\stackrel{催化剂}{→}$N2+2H2O,F装置:用浓硫酸吸收尾气氨气.
(1)氯化铵固体和氢氧化钙固体在加热的条件下发生反应生成氨气;
(2)混合气体通过浓氨水能进行气体均匀混合,同时通过逸出气泡数量监测反应的速率;F装置:用浓硫酸吸收尾气氨气;
(3)由方程式可知,反应中NH3→N2氮元素化合价由-3价升高为0价,每转移24mol电子消耗NO2的物质的量为6mol,据此计算转移3.6mol电子时,消耗NO2的物质的量;
Ⅲ.(1)根据反应:NO+NO2+2NaOH═2NaNO2+H2O;2NO2+2NaOH═NaNO2+NaNO3+H2O,混合气体通入NaOH溶液被完全吸收时,应满足n(NO2)≥n(NO)即可;
(2)反应产物NaNO2、NaNO3,根据Na和N原子守恒,n(NaOH)=$\frac{2240×1{0}^{-3}}{22.4}$mol=0.1mol,带入c=$\frac{n}{V}$计算浓度;
Ⅳ.氮氧化物有毒,对环境有污染,与氨催化吸收法比较,操作简便,产物为盐,可回收作氮肥,缺点是消耗碱.
解答 解:Ⅰ.氮氧化物NOx可形成硝酸型酸雨,光化学烟雾是城市大气中的碳氢化合物(HC)和氮氧化合物(NOx)在阳光紫外线的作用下发生的一系列链式大气化学反应生成以臭氧(O3)为代表的刺激性二次污染物,氮氧化物NOx,可形成光化学烟雾,
故答案为:酸雨;光化学烟雾;
Ⅱ.(1)氯化铵固体和氢氧化钙固体在加热的条件下发生反应生成氨气,所以装置A的反应是:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)C装置:一个作用是通过气泡产生的速率来控制反应物的比例,使氨气和一氧化氮混合均匀,F装置:用浓硫酸吸收尾气氨气,
故答案为:使氨气和一氧化氮混合均匀;吸收尾气;
(3)由方程式可知,反应中NH3→N2氮元素化合价由-3价升高为0价,每转移24mol电子消耗NO2的物质的量为6mol,转移3.6mol电子时,消耗NO2的物质的量为$\frac{3.6}{24}$×6=0.9mol,故答案为:0.9;
Ⅲ.(1)由方程式可知混合气体通入NaOH溶液被完全吸收时,应满足n(NO2)≥n(NO),即x≥1.5,所以CD符合,
故答案为:CD;
(2)反应产物NaNO2、NaNO3,根据Na和N原子守恒,n(NaOH)=$\frac{2240×1{0}^{-3}}{22.4}$mol=0.1mol,NaOH溶液物质的量浓度c=$\frac{0.1mol}{0.2L}$=0.5mol/L,
故答案为:0.5mol/L;
Ⅳ.氮氧化物有毒,对环境有污染,用氢氧化钠吸收氮氧化物能将有毒气体转化为无毒物质,防止有毒气体的污染,操作简便,同时产物为盐,可回收作氮肥,缺点是消耗强碱,生成盐,不经济,
故答案为:操作简便,产物为盐,可回收作氮肥;不经济.
点评 本题通过以氮氧化物处理为载体考查了性质实验,侧重考查性质实验方案的评价,题目难度中等,明确氮及其化合物的性质是解本题关键,注意掌握性质实验方案的评价中的比较法,试题充分考查了学生的分析、理解能力及化学实验能力.

| A. | 距原子核最近 | B. | 必有成对电子 | C. | 球形对称 | D. | 具有方向性 |
| A. | 向试液中滴加氯化钡溶液,产生白色沉淀,则溶液中一定含有CO32- | |
| B. | 向试液中滴加浓氢氧化钠溶液,加热产生刺激性气味的气体,则溶液中一定含有NH4+ | |
| C. | 向试液中滴加硝酸银溶液,产生白色沉淀,则溶液中一定含有Cl- | |
| D. | 向试液中滴加盐酸,产生的气体能使品红溶液褪色,则溶液中一定含有SO32- |
| A. | CCl4 | B. | KI | C. | KCl | D. | Cl2 |
| A. | 固体SiO2一定是晶体 | |
| B. | 晶体有固定的组成,非晶体没有固定的组成 | |
| C. | 晶体内部的微粒按一定规律呈周期性有序排列 | |
| D. | 晶体的基本结构单元(晶胞)全部是平行六面体 |
| A. | 1:1:1 | B. | 1:3:3 | C. | 1:2:3 | D. | 2:3:3 |
| 实验编号 | 起始浓度 (mol/L) | 反应后溶液的pH | |
| C(HA) | C(NaOH) | ||
| ① | 0.10 | 0.10 | 9 |
| ② | x | 0.05 | 7 |
| A. | HA是弱酸 | |
| B. | x>0.05 | |
| C. | 实验①所得溶液中:c(A-)+c(HA)=0.10mol/L | |
| D. | 实验②所得溶液中:c(Na+)=c(A-) |
 用如图所示装置测定氮肥[NH4HCO3中含(NH4)2CO3]中NH4HCO3的质量分数(不考虑铵盐溶液分解).
用如图所示装置测定氮肥[NH4HCO3中含(NH4)2CO3]中NH4HCO3的质量分数(不考虑铵盐溶液分解).