题目内容
3.下列离子检验的步骤、现象和结论都正确的是( )| A. | 向试液中滴加氯化钡溶液,产生白色沉淀,则溶液中一定含有CO32- | |
| B. | 向试液中滴加浓氢氧化钠溶液,加热产生刺激性气味的气体,则溶液中一定含有NH4+ | |
| C. | 向试液中滴加硝酸银溶液,产生白色沉淀,则溶液中一定含有Cl- | |
| D. | 向试液中滴加盐酸,产生的气体能使品红溶液褪色,则溶液中一定含有SO32- |
分析 A.白色沉淀可能为AgCl、硫酸钡等;
B.产生刺激性气味的气体为氨气;
C.白色沉淀可能为硫酸银;
D.亚硫酸氢根离子与盐酸反应生成二氧化硫.
解答 解:A.白色沉淀可能为AgCl、硫酸钡等,则溶液中不一定含有CO32-,故A错误;
B.产生刺激性气味的气体为氨气,则溶液中一定含有NH4+,故B正确;
C.白色沉淀可能为硫酸银,则溶液中不一定含有Cl-,故C错误;
D.亚硫酸氢根离子与盐酸反应生成二氧化硫,则溶液中含有SO32-或HSO3-,或都有,故D错误;
故选B.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、现象及结论为解答本题的关键,侧重分析与实验的考查,注意检验时排除干扰离子,题目难度不大.

练习册系列答案
相关题目
11.用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,36g18O2中所含的中子数为16NA | |
| B. | 1mol乙烯分子中含有共用电子对数为6NA | |
| C. | 电解饱和食盐水时,阳极上生成22.4L气体时转移的电子数为2NA | |
| D. | 标准状况下,2.24LCl2溶于水达到饱和,可得到HClO分子的数目是0.1NA |
18.物质应用与其性质密切相关,下列说法错误的是( )
| A. | 硅胶可防止食物受潮是由于其具有吸水性 | |
| B. | 葡萄糖用于医疗输液是因为它属于强电解质 | |
| C. | Na2CO3可用作食用碱,因为Na2CO3的水溶液显碱性 | |
| D. | 酸性重铬酸钾用于检查酒驾是利用其强氧化性 |
8.根据题目提供的溶度积数据进行计算并回答下列问题:
(1)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
25℃时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为蓝色.
(2)向50mL0.018mol•L-1的AgNO3溶液中加入50mL0.020mol•L-1的盐酸,生成沉淀.已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=1.0×10-7 mol•L-1.
②完全沉淀后,溶液的pH=2.
③如果向完全沉淀后的溶液中继续加入50mL0.001mol•L-1的盐酸,是否有白色沉淀生成?否(填“是”或“否”).
(3)在某温度下,Ksp(FeS)=6.25×10-18,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:c2(H+)•c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到1mol•L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)约为4×10-3mol/L.
(1)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
(2)向50mL0.018mol•L-1的AgNO3溶液中加入50mL0.020mol•L-1的盐酸,生成沉淀.已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=1.0×10-7 mol•L-1.
②完全沉淀后,溶液的pH=2.
③如果向完全沉淀后的溶液中继续加入50mL0.001mol•L-1的盐酸,是否有白色沉淀生成?否(填“是”或“否”).
(3)在某温度下,Ksp(FeS)=6.25×10-18,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:c2(H+)•c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到1mol•L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)约为4×10-3mol/L.
12.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.如图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
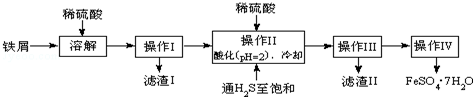
查询资料,得有关物质的数据如下:
(1)加稀硫酸的溶解中,铁作还原剂的离子方程式为Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+.
(2)操作Ⅱ中:
①通入硫化氢至饱和的目的是a除去溶液中的Sn2+离子;b防止Fe2+被氧化;
②在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(3)操作IV的顺序依次为蒸发浓缩、冷却结晶、过滤、洗涤.

查询资料,得有关物质的数据如下:
| 25℃时 | pH值 | 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
(2)操作Ⅱ中:
①通入硫化氢至饱和的目的是a除去溶液中的Sn2+离子;b防止Fe2+被氧化;
②在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(3)操作IV的顺序依次为蒸发浓缩、冷却结晶、过滤、洗涤.
16.将SO2气体通入下列溶液中,观察不到明显现象的是( )
| A. | BaCl2 | B. | 石蕊溶液 | C. | 酸性KMnO4溶液 | D. | 氢硫酸 |