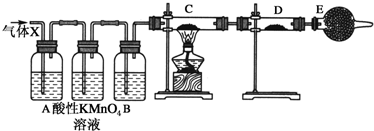
题目内容
12.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )| A. | 0.05molNa2O2固体中含有的阴离子数均为0.05NA | |
| B. | 标准状况下,2.24LCH4所含的原子数为0.1NA | |
| C. | 1molSO2与足量O2在一定条件下反应,共转移2NA个电子 | |
| D. | 1L0.1mol/L氨水中含有的NH3•H2O分子数为0.1NA |
分析 A、过氧化钠由2个钠离子和1个阴离子构成;
B、求出甲烷的物质的量,然后根据甲烷由5个原子构成;
C、二氧化硫和氧气的反应为可逆反应;
D、一水合氨为弱电解质,在溶液中能部分电离.
解答 解:A、过氧化钠由2个钠离子和1个阴离子构成,故0.05mol过氧化钠中含0.05mol阴离子即0.05NA个,故A正确;
B、标况下2.24L甲烷的物质的量为0.1mol,而甲烷由5个原子构成,故0.1mol甲烷中含0.5mol原子即0.5NA个,故B错误;
C、二氧化硫和氧气的反应为可逆反应,不能进行彻底,故转移的电子数小于2NA个,故C错误;
D、一水合氨为弱电解质,在溶液中能部分电离,故溶液中含有的一水合氨分子个数小于0.1NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
2.双隔膜电解池的结构示意简图如图所示,利用铅蓄电池电解Na2SO4溶液可以制取H2SO4和NaOH,并得到H2和O2,.对该装置及其原理判断中,不正确的是( )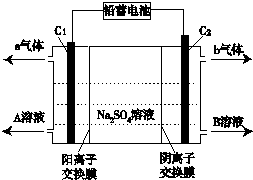

| A. | C1极电极与铅蓄电池的Pb电极相接,C2极与铅蓄电池的PbO2电极相接 | |
| B. | 当C1极产生标准状况下11.2 L气体时,铅蓄电池的负极增重64g | |
| C. | A溶液为氢氧化钠溶液,B溶液为硫酸 | |
| D. | 该电解反应的总方程式可以表示为:2Na2SO4+6H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑ |
3.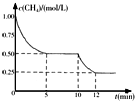 密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )
密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )
 密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )
密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )| A. | 0~5 min内,v(H2)=0.1 mol/(L•min) | |
| B. | 10 min时改变的外界条件可能是升高温度 | |
| C. | 恒温下,缩小容器体积,平衡后c(H2)减小 | |
| D. | 12 min时反应达平衡的本质原因是气体总质量不再变化 |
20.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | l mol H20最多可形成氢键数目为2NA | |
| B. | 标准状况下,11.2 L甲醛所含的σ键数目为2NA | |
| C. | 常温下,46 g N02所含分子数目为NA | |
| D. | pH=l的硫酸中所含S042-的数目为0.05NA |
17.某无色混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体.现将此混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色.对于原混合气体成份的判断正确的是( )
| A. | 肯定含有SO2和NO | B. | 肯定含有NO和O2 | ||
| C. | 可能有Cl2 | D. | 肯定没有Cl2、NO2,可能有O2 |
1.下列不属于有机物的原子成键特点的是( )
| A. | 碳原子易失去最外层的电子形成离子 | |
| B. | 碳原子最外层电子易于其他原子的外层电子形成共同电子对 | |
| C. | 组成有机物的碳原子可以形成单键、双键和三键等多种成键形式 | |
| D. | 组成有机物的氧原子、氮原子、卤素原子分别形成2个、3个、1个共价键 |
19.实验中需要1mol/L的CuSO4溶液480mL,配制溶液时需要称取( )
| A. | 125.0克CuSO4•5H2O 晶体 | B. | 76.8克无水CuSO4 固体 | ||
| C. | 120.0克CuSO4•5H2O 晶体 | D. | 40.0克无水CuSO4固体 |