题目内容
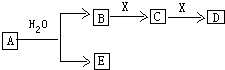
4.某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气.为了验证甲、乙两同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置已略去).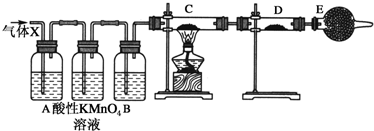
请回答:
(1)上述实验中生成二氧化硫气体的化学方程式为Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O.
(2)乙同学认为还可能产生氢气的理由是当Zn与浓H2SO4反应时,浓H2SO4浓度逐渐变稀,Zn与稀H2SO4反应可产生H2.
(3)A中加入的试剂可能是品红溶液,作用是检验SO2;B中加入的试剂可能是浓H2SO4,其作用是吸收水蒸气;E中加入的试剂可能是碱石灰,作用是防止空气中的水蒸气进入D中.
(4)可以证明气体X中含有氢气的实验现象:
C中:黑色粉末变成红色,
D中:白色粉末变成蓝色.
如果去掉装置B,还能否根据D中的现象判断气体X中含有氢气?不能(填“能”或“不能”),原因是通过品红溶液、酸性KMnO4溶液后,混合气体中可能含H2O,会干扰H2的检验.
(5)工业上常常将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4,该过程的化学方程式为2Cu+2H2SO4(稀)+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O.
分析 (1)锌与浓硫酸加热反应生成硫酸锌和二氧化硫、水;
(2)浓硫酸具有强的氧化性,与锌反应对应还原产物为二氧化硫,随着反应进行浓硫酸浓度降低变为稀硫酸,稀硫酸与锌反应生成硫酸锌和氢气;
(3)二氧化硫具有漂白性,能使品红溶液褪色,所以可以用品红溶液检验二氧化硫;浓硫酸具有吸水性;空气中含有水蒸气,应连接干燥装置防止干扰实验;
(4)氢气具有还原性,能还原部分金属氧化生成水,水可以用无水硫酸铜检验,从而检验氢气;B装置的作用是吸收水,防止水蒸气对后面的氢气的检验造成干扰;
(5)铜与氧气、硫酸反应生成硫酸铜和水.
解答 解:(1)锌与浓硫酸加热反应生成硫酸锌和二氧化硫、水,化学方程式:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O;
故答案为:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O;
(2)浓硫酸具有强的氧化性,与锌反应对应还原产物为二氧化硫,随着反应进行浓硫酸浓度降低变为稀硫酸,稀硫酸与锌反应生成硫酸锌和氢气;
故答案为:当Zn与浓H2SO4反应时,浓H2SO4浓度逐渐变稀,Zn与稀H2SO4反应可产生H2;
(3)二氧化硫具有漂白性,能使品红溶液褪色,所以可以用品红溶液检验二氧化硫;酸性高锰酸溶液能氧化二氧化硫导致酸性高锰酸钾溶液褪色,水溶液中含有水蒸气,影响氢气检验,为防止水蒸气干扰,用浓硫酸干燥气体,所以C中盛放浓硫酸,目的是吸收水蒸气;空气中含有水蒸气,干扰氢气的检验,所以E中盛放碱石灰,目的是吸收水蒸气,
故答案为:品红溶液;检验SO2;浓H2SO4;吸收水蒸气;碱石灰;防止空气中的水蒸气进入D装置;
(4)氢气具有还原性,能还原部分金属氧化生成水,水可以用无水硫酸铜检验,根据元素守恒知,气体X中含有氢气,看到的现象是:C中黑色固体变为红色,D中白色固体变为蓝色;
通过品红溶液、酸性KMnO4溶液后,混合气体中可能含H2O,会干扰H2的检验,所以如果去掉装置B,不能根据D中的现象判断气体X中含有氢气;
故答案为:C中黑色固体变为红色,D中白色固体变为蓝色;
不能;通过品红溶液、酸性KMnO4溶液后,混合气体中可能含H2O,会干扰H2的检验;
(5)铜与氧气、硫酸反应生成硫酸铜和水,方程式:2Cu+2H2SO4(稀)+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;
故答案为:2Cu+2H2SO4(稀)+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;
点评 本题考查性质实验方案设计,侧重考查学生实验基本操作、物质的性质、物质的检验等知识点,明确物质的性质是解题关键,注意实验设计的严密性,题目难度中等.

 发散思维新课堂系列答案
发散思维新课堂系列答案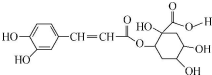
| A. | 每个分子中含有4个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1mol该有机物只能与1molBr2发生反应 | |
| D. | 1mol该有机物最多与8molNaOH反应 |
| A. | 0.05molNa2O2固体中含有的阴离子数均为0.05NA | |
| B. | 标准状况下,2.24LCH4所含的原子数为0.1NA | |
| C. | 1molSO2与足量O2在一定条件下反应,共转移2NA个电子 | |
| D. | 1L0.1mol/L氨水中含有的NH3•H2O分子数为0.1NA |
| A. | 非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数 | |
| B. | 非金属元素呈现的最高化合价不超过该元素原子的最外层电子数 | |
| C. | 最外层有2个电子的原子都是金属原子 | |
| D. | 金属元素只有正价和零价,而非金属元素既有正价又有负价又有零价 |
| A. |  利用甘油密度大于乙醇且更易溶于水,进行甘油与乙醇的混合物分离 | |
| B. | 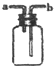 进行H2,NH3,CO2,Cl2,HCl,NO2等气体收集,也能用于NO气体收集 | |
| C. |  当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 | |
| D. | 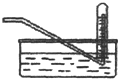 常用于实验室收集氧气、氢气等 |
| A. | C02 | B. | S02 | C. | N2 | D. | HC1 |
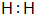 .
.