题目内容
7.用化学式填空:漂白粉有效成分Ca(ClO)2;工业上制光导纤维的材料SiO2;工业上生产玻璃和水泥都用到的原料CaCO3.
分析 漂白粉成分为氯化钙和次氯酸钙的混合物,光导纤维成分为二氧化硅,水泥的原料是粘土和石灰石,玻璃的原料是纯碱、石灰石和石英,所以原料中均有石灰石即碳酸钙;
解答 解:漂白粉是利用氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,成分为氯化钙和次氯酸钙,有效成分为次氯酸钙Ca(ClO)2,生产光导纤维的原理为二氧化硅SiO2,生产玻璃的原料是纯碱、石灰石和石英,高温下,碳酸钠、碳酸钙和二氧化硅反应分别生成硅酸钠、硅酸钙;生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥;所以在玻璃工业、水泥工业中都用到的原料是石灰石CaCO3,
故答案为:Ca(ClO)2,SiO2,CaCO3;
点评 本题主要考查了化学与生活中的材料知识,平时注意基础知识的积累,注意玻璃工业、水泥工业的生产原理,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.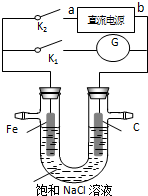 某实验兴趣小组设计如下微型实验装置,a、b为直流电源的两极.实验时,若断开K1,闭合K2,两极均有气泡产生,下列有关描述正确的是( )
某实验兴趣小组设计如下微型实验装置,a、b为直流电源的两极.实验时,若断开K1,闭合K2,两极均有气泡产生,下列有关描述正确的是( )
 某实验兴趣小组设计如下微型实验装置,a、b为直流电源的两极.实验时,若断开K1,闭合K2,两极均有气泡产生,下列有关描述正确的是( )
某实验兴趣小组设计如下微型实验装置,a、b为直流电源的两极.实验时,若断开K1,闭合K2,两极均有气泡产生,下列有关描述正确的是( )| A. | 断开K1闭合K2时,铁电极附近溶液pH逐渐升高 | |
| B. | 断开K2闭合K1时,Fe电极被保护,此法称为牺牲阳极的阴极保护法电解 | |
| C. | 断开K1闭合K2时,电子沿“a→Fe→电解质溶液→C→b”的路径流动 | |
| D. | 断开K1闭合K2时,总反应的离子方程式为2H++2Cl- $\stackrel{电解}{→}$ H2↑+Cl2↑ |
18.化学与材料、生活和环境密切相关.下列有关说法中错误的是( )
| A. | 食品袋中常放有硅胶和铁粉,都能起到干燥的作用 | |
| B. | 大力实施矿物燃料脱硫脱硝技术,能减少硫、氮氧化物的排放 | |
| C. | 明矾净水时发生了化学及物理变化,能起到净水作用,而没有杀菌、消毒的作用 | |
| D. | 某新型航天服材料主要成分是由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 |
2.利用下列实验装置能达到相应实验目的是( )
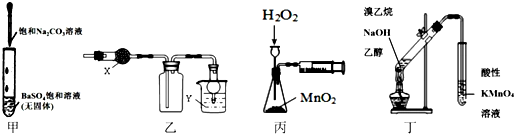

| A. | 甲可用于研究沉淀的转化,可比较出Ksp(BaSO4>Ksp(BaCO3) | |
| B. | 乙中X为无水CaCl2,Y为NaOH溶液时,该装置可用于SO2的收集 | |
| C. | 丙装置可定量测定H2O2的分解速率 | |
| D. | 丁可用于证明实验中生成了乙烯 |
12.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 0.05molNa2O2固体中含有的阴离子数均为0.05NA | |
| B. | 标准状况下,2.24LCH4所含的原子数为0.1NA | |
| C. | 1molSO2与足量O2在一定条件下反应,共转移2NA个电子 | |
| D. | 1L0.1mol/L氨水中含有的NH3•H2O分子数为0.1NA |
16.下列说法中正确的是( )
| A. | 非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数 | |
| B. | 非金属元素呈现的最高化合价不超过该元素原子的最外层电子数 | |
| C. | 最外层有2个电子的原子都是金属原子 | |
| D. | 金属元素只有正价和零价,而非金属元素既有正价又有负价又有零价 |
14.在溶液中能大量共存的离子组是( )
| A. | Na+、OH-、HCO3- | B. | Ag+、Fe3+、Cl- | C. | NH4+、K+、OH- | D. | Ba2+、OH-、Cl- |
 .
.