题目内容
2.双隔膜电解池的结构示意简图如图所示,利用铅蓄电池电解Na2SO4溶液可以制取H2SO4和NaOH,并得到H2和O2,.对该装置及其原理判断中,不正确的是( )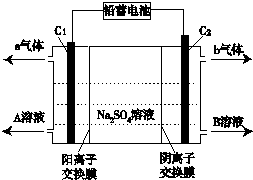
| A. | C1极电极与铅蓄电池的Pb电极相接,C2极与铅蓄电池的PbO2电极相接 | |
| B. | 当C1极产生标准状况下11.2 L气体时,铅蓄电池的负极增重64g | |
| C. | A溶液为氢氧化钠溶液,B溶液为硫酸 | |
| D. | 该电解反应的总方程式可以表示为:2Na2SO4+6H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑ |
分析 用铅蓄电池电解Na2SO4溶液可以制取H2SO4和NaOH,并得到H2和O2,根据图知,左侧为阳极时,C1极为阳极、C2极为阴极,C1极上H2O失电子生成O2和H+,所以e气体是O2,得到的溶液是NaOH溶液;
C2极上H2O得电子生成H2和OH-,所以b气体是H2,B溶液是H2SO4,
A.阳极与电源正极相连、阴极与电源负极相连;
B.铅蓄电池负极上Pb失电子和SO42-反应生成PbSO4,负极增加的质量为SO42-质量,根据转移电子守恒计算铅蓄电池负极增加质量;
C.A是NaOH溶液、B为硫酸;
D.电解时阳极上生成O2和硫酸、阴极上生成H2和NaOH.
解答 解:用铅蓄电池电解Na2SO4溶液可以制取H2SO4和NaOH,并得到H2和O2,根据图知,左侧为阳极时,C1极为阳极、C2极为阴极,C1极上H2O失电子生成O2和H+,所以e气体是O2,得到的溶液是NaOH溶液;
C2极上H2O得电子生成H2和OH-,所以b气体是H2,B溶液是H2SO4,
A.阳极与电源正极相连、阴极与电源负极相连,铅蓄电池中Pb是负极、PbO2是正极,C1极为阳极、C2极为阴极,所以C1极电极与铅蓄电池的Pb电极相接,C2极与铅蓄电池的PbO2电极相接,故A正确;
B.铅蓄电池负极上Pb失电子和SO42-反应生成PbSO4,负极增加的质量为SO42-质量,
当C1极产生标准状况下11.2 L气体时,转移电子物质的量=$\frac{11.2L}{22.4L/mol}$×4=2mol,负极反应式为Pb-2e-+SO42-=PbSO4,根据转移电子守恒得参加反应的n(SO42-)=$\frac{2mol}{2}×1$=1mol,则负极增加的质量m(SO42-)=1mol×96g/mol=96g,故B错误;
C.通过以上分析知,A是NaOH溶液、B为硫酸,故C正确;
D.电解时阳极上生成O2和硫酸、阴极上生成H2和NaOH,所以电池反应式为2Na2SO4+6H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑,故D正确;
故选B.
点评 本题考查原电池和电解池原理,为高频考点,明确电解池中各个电极上发生的反应、生成气体成分及溶液成分是解本题关键,侧重考查学生分析计算能力,易错选项是B,注意Pb电极放电过程中增加质量为硫酸根离子质量,题目难度不大.

| A. | 构成原电池的电极是两种不同的金属 | |
| B. | 原电池是将化学能转化为电能的装置 | |
| C. | 原电池负极发生的电极反应是还原反应 | |
| D. | 原电池的正极是还原剂,总是溶液中的阳离子在此被还原 |
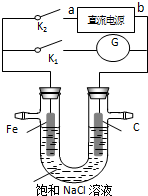 某实验兴趣小组设计如下微型实验装置,a、b为直流电源的两极.实验时,若断开K1,闭合K2,两极均有气泡产生,下列有关描述正确的是( )
某实验兴趣小组设计如下微型实验装置,a、b为直流电源的两极.实验时,若断开K1,闭合K2,两极均有气泡产生,下列有关描述正确的是( )| A. | 断开K1闭合K2时,铁电极附近溶液pH逐渐升高 | |
| B. | 断开K2闭合K1时,Fe电极被保护,此法称为牺牲阳极的阴极保护法电解 | |
| C. | 断开K1闭合K2时,电子沿“a→Fe→电解质溶液→C→b”的路径流动 | |
| D. | 断开K1闭合K2时,总反应的离子方程式为2H++2Cl- $\stackrel{电解}{→}$ H2↑+Cl2↑ |
| A. | 白醋中滴入石蕊溶液呈红色 | |
| B. | 白醋加入豆浆中有沉淀产生 | |
| C. | 蛋壳浸泡在白醋中有气体放出 | |
| D. | 测得白醋溶液中的c(H+)在1×10-2 mol•L-1到1×10-3 mol•L-1之间 |
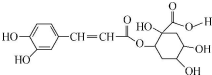
| A. | 每个分子中含有4个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1mol该有机物只能与1molBr2发生反应 | |
| D. | 1mol该有机物最多与8molNaOH反应 |
 某溶液可能含有如表离子
某溶液可能含有如表离子| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | SO42-、OH- |
提示:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O
请回答下列问题:
(1)产生的气体是NH3和O2.
(2)上述溶液中一定存在的离子是H+、Al3+、NH4+、Mg2+、SO42-.图中横坐标字母c=9mol.
(3)加Na2O2固体到bmol时所得沉淀的化学式Mg(OH)2和Al(OH)3.
(4)用离子方程式表示加Na2O2固体到amol前没有出现沉淀的原因2Na2O2+4H+=4Na+2H2O+O2↑.
(5)检验溶液中还可能大量含有的离子,其具体操作是用铂丝蘸蘸取溶液在无色火焰上灼烧,透过蓝色钴玻璃观察火焰颜色,若呈紫色,则证明有K+,反之,则证明没有K+.
| A. | 0.05molNa2O2固体中含有的阴离子数均为0.05NA | |
| B. | 标准状况下,2.24LCH4所含的原子数为0.1NA | |
| C. | 1molSO2与足量O2在一定条件下反应,共转移2NA个电子 | |
| D. | 1L0.1mol/L氨水中含有的NH3•H2O分子数为0.1NA |