题目内容
17.某无色混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体.现将此混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色.对于原混合气体成份的判断正确的是( )| A. | 肯定含有SO2和NO | B. | 肯定含有NO和O2 | ||
| C. | 可能有Cl2 | D. | 肯定没有Cl2、NO2,可能有O2 |
分析 根据气体的颜色判断可排除Cl2和NO2气体,能使品红褪色的气体为SO2,把剩余气体排入空气中,很快变为红棕色,说明含有气体NO,以此解答该题.
解答 解:气体无色,则说明不含有Cl2和NO2气体,此无色混合气体通过品红溶液后,品红溶液褪色,说明一定含有SO2,把剩余气体排入空气中,很快变为红棕色,说明含有气体NO,则一定没有O2,综上可得,混合物中肯定没有Cl2、O2和NO2,一定含有SO2、NO.
故选A.
点评 本题考查物质的检验和鉴别,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质,解答本题要从物质的颜色、物质之间相互作用时的实验现象等方面进行分析、判断,从而得出正确的结论,难度不大.

练习册系列答案
相关题目
7.用食用白醋(醋酸浓度约为1mol•L-1)进行下列实验,能证明醋酸是弱电解质的是( )
| A. | 白醋中滴入石蕊溶液呈红色 | |
| B. | 白醋加入豆浆中有沉淀产生 | |
| C. | 蛋壳浸泡在白醋中有气体放出 | |
| D. | 测得白醋溶液中的c(H+)在1×10-2 mol•L-1到1×10-3 mol•L-1之间 |
5.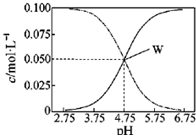 25℃,有c(CH3COOH)+c(CH3COO-)=0.l mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )
25℃,有c(CH3COOH)+c(CH3COO-)=0.l mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )
 25℃,有c(CH3COOH)+c(CH3COO-)=0.l mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )
25℃,有c(CH3COOH)+c(CH3COO-)=0.l mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )| A. | pH=5.5溶液中:c(CH3COO->c(CH3COOH)>c(H+)>c(OH一) | |
| B. | W点表示溶液中:c(Na+)=c(CH3COO-) | |
| C. | pH=3.5溶液中:c(Na+)-c(OH-)+c(CH3COOH)=0.l moL/L | |
| D. | 向W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |
12.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 0.05molNa2O2固体中含有的阴离子数均为0.05NA | |
| B. | 标准状况下,2.24LCH4所含的原子数为0.1NA | |
| C. | 1molSO2与足量O2在一定条件下反应,共转移2NA个电子 | |
| D. | 1L0.1mol/L氨水中含有的NH3•H2O分子数为0.1NA |
2.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 23gNa与足量H2O反应完全后失去2NA个电子 | |
| B. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 标准状况下,22.4LN2和H2混合气中含2NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去9NA个电子 |
 实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配置情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配置情况回答下列问题: