题目内容
3.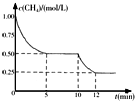 密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )
密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )| A. | 0~5 min内,v(H2)=0.1 mol/(L•min) | |
| B. | 10 min时改变的外界条件可能是升高温度 | |
| C. | 恒温下,缩小容器体积,平衡后c(H2)减小 | |
| D. | 12 min时反应达平衡的本质原因是气体总质量不再变化 |
分析 A.根据图可知,前5min内甲烷的浓度由1.00mol/L减小为0.50mol/L,根据v=$\frac{△c}{△t}$计算c(CH4),再利用速率之比等于化学计量数之比计算v(H2);
B.由图可知,10min时甲烷的浓度继续减小,反应向正反应方向移动;
C.恒温下,缩小容器体积,压强增大,平衡向逆反应方向移动,移动的结果降低氢气浓度的增大,但不会消除浓度增大;
D.反应达平衡的本质是正、逆速率相等.
解答 解:A.根据图可知,前5min内甲烷的浓度由1.00mol/L减小为0.50mol/L,故c(CH4)=$\frac{1-0.5}{5}$=0.1mol/(L•min),由化学计量数之比等于反应速率之比,则v(H2)=3×0.1mol/(L•min)=0.3mol/(L•min),故A错误;
B.由图可知,10min时甲烷的浓度继续减小,该反应向正反应方向移动,该反应正反应是吸热反应,可能是升高温度,故B正确;
C.恒温下,缩小容器体积,压强增大,平衡向逆反应方向移动,移动的结果降低氢气浓度的增大,但不会消除浓度增大,平衡后c(H2)增大,故C错误;
D.反应达平衡的本质是正、逆速率相等,故D错误;
故选B.
点评 本题考查化学平衡图象,涉及反应速率的计算、化学平衡的影响因素、化学平衡状态本质,难度中等,注意根据浓度变化判断可能改变的条件.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
13.关于原电池的叙述中正确的是( )
| A. | 构成原电池的电极是两种不同的金属 | |
| B. | 原电池是将化学能转化为电能的装置 | |
| C. | 原电池负极发生的电极反应是还原反应 | |
| D. | 原电池的正极是还原剂,总是溶液中的阳离子在此被还原 |
14.咖啡和茶叶中富含漂木酸,它具有抗癌作用,其结构简式如图.下列有关说法正确的是( )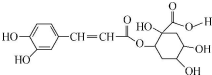

| A. | 每个分子中含有4个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1mol该有机物只能与1molBr2发生反应 | |
| D. | 1mol该有机物最多与8molNaOH反应 |
11. 某溶液可能含有如表离子
某溶液可能含有如表离子
将Na2O2逐渐加入到上述溶液并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如图.
提示:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O
请回答下列问题:
(1)产生的气体是NH3和O2.
(2)上述溶液中一定存在的离子是H+、Al3+、NH4+、Mg2+、SO42-.图中横坐标字母c=9mol.
(3)加Na2O2固体到bmol时所得沉淀的化学式Mg(OH)2和Al(OH)3.
(4)用离子方程式表示加Na2O2固体到amol前没有出现沉淀的原因2Na2O2+4H+=4Na+2H2O+O2↑.
(5)检验溶液中还可能大量含有的离子,其具体操作是用铂丝蘸蘸取溶液在无色火焰上灼烧,透过蓝色钴玻璃观察火焰颜色,若呈紫色,则证明有K+,反之,则证明没有K+.
 某溶液可能含有如表离子
某溶液可能含有如表离子| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | SO42-、OH- |
提示:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O
请回答下列问题:
(1)产生的气体是NH3和O2.
(2)上述溶液中一定存在的离子是H+、Al3+、NH4+、Mg2+、SO42-.图中横坐标字母c=9mol.
(3)加Na2O2固体到bmol时所得沉淀的化学式Mg(OH)2和Al(OH)3.
(4)用离子方程式表示加Na2O2固体到amol前没有出现沉淀的原因2Na2O2+4H+=4Na+2H2O+O2↑.
(5)检验溶液中还可能大量含有的离子,其具体操作是用铂丝蘸蘸取溶液在无色火焰上灼烧,透过蓝色钴玻璃观察火焰颜色,若呈紫色,则证明有K+,反之,则证明没有K+.
18.化学与材料、生活和环境密切相关.下列有关说法中错误的是( )
| A. | 食品袋中常放有硅胶和铁粉,都能起到干燥的作用 | |
| B. | 大力实施矿物燃料脱硫脱硝技术,能减少硫、氮氧化物的排放 | |
| C. | 明矾净水时发生了化学及物理变化,能起到净水作用,而没有杀菌、消毒的作用 | |
| D. | 某新型航天服材料主要成分是由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 |
12.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 0.05molNa2O2固体中含有的阴离子数均为0.05NA | |
| B. | 标准状况下,2.24LCH4所含的原子数为0.1NA | |
| C. | 1molSO2与足量O2在一定条件下反应,共转移2NA个电子 | |
| D. | 1L0.1mol/L氨水中含有的NH3•H2O分子数为0.1NA |
10.下列有关实验操作的叙述中正确的是( )
| A. |  利用甘油密度大于乙醇且更易溶于水,进行甘油与乙醇的混合物分离 | |
| B. | 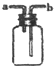 进行H2,NH3,CO2,Cl2,HCl,NO2等气体收集,也能用于NO气体收集 | |
| C. |  当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 | |
| D. | 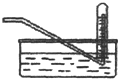 常用于实验室收集氧气、氢气等 |