题目内容
1.下列不属于有机物的原子成键特点的是( )| A. | 碳原子易失去最外层的电子形成离子 | |
| B. | 碳原子最外层电子易于其他原子的外层电子形成共同电子对 | |
| C. | 组成有机物的碳原子可以形成单键、双键和三键等多种成键形式 | |
| D. | 组成有机物的氧原子、氮原子、卤素原子分别形成2个、3个、1个共价键 |
分析 A.碳原子最外层有4个电子,不易失去或获得电子而形成阳离子或阴离子;
B.每个碳原子可以与碳原子或其它非金属原子形成4个键;
C.碳原子与碳原子可以形成饱和键,也可以形成不饱和键;
D.氧原子、氮原子、卤素原子最外层的电子数为6、5、7.
解答 解:A.碳原子最外层有4个电子,不易失去或获得电子而形成阳离子或阴离子,故A错误;
B.根据碳原子的成键特点,每个碳原子可以与碳原子或其它非金属原子形成4个键,故B正确;
C.碳原子之间都以碳碳单键结合成链状,碳原子与碳原子也可以形成不饱和键,双键和三键等多种成键形式,故C正确;
D.氧原子、氮原子、卤素原子最外层的电子数为6、5、7,可以与其他原子形成2、3、1个共价键,故D正确;
故选A.
点评 本题主要考查了碳原子的成键特点及成键方式,题目难度不大,侧重于基础知识的考查,注意知识的积累.

练习册系列答案
相关题目
11. 某溶液可能含有如表离子
某溶液可能含有如表离子
将Na2O2逐渐加入到上述溶液并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如图.
提示:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O
请回答下列问题:
(1)产生的气体是NH3和O2.
(2)上述溶液中一定存在的离子是H+、Al3+、NH4+、Mg2+、SO42-.图中横坐标字母c=9mol.
(3)加Na2O2固体到bmol时所得沉淀的化学式Mg(OH)2和Al(OH)3.
(4)用离子方程式表示加Na2O2固体到amol前没有出现沉淀的原因2Na2O2+4H+=4Na+2H2O+O2↑.
(5)检验溶液中还可能大量含有的离子,其具体操作是用铂丝蘸蘸取溶液在无色火焰上灼烧,透过蓝色钴玻璃观察火焰颜色,若呈紫色,则证明有K+,反之,则证明没有K+.
 某溶液可能含有如表离子
某溶液可能含有如表离子| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | SO42-、OH- |
提示:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O
请回答下列问题:
(1)产生的气体是NH3和O2.
(2)上述溶液中一定存在的离子是H+、Al3+、NH4+、Mg2+、SO42-.图中横坐标字母c=9mol.
(3)加Na2O2固体到bmol时所得沉淀的化学式Mg(OH)2和Al(OH)3.
(4)用离子方程式表示加Na2O2固体到amol前没有出现沉淀的原因2Na2O2+4H+=4Na+2H2O+O2↑.
(5)检验溶液中还可能大量含有的离子,其具体操作是用铂丝蘸蘸取溶液在无色火焰上灼烧,透过蓝色钴玻璃观察火焰颜色,若呈紫色,则证明有K+,反之,则证明没有K+.
12.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 0.05molNa2O2固体中含有的阴离子数均为0.05NA | |
| B. | 标准状况下,2.24LCH4所含的原子数为0.1NA | |
| C. | 1molSO2与足量O2在一定条件下反应,共转移2NA个电子 | |
| D. | 1L0.1mol/L氨水中含有的NH3•H2O分子数为0.1NA |
16.下列说法中正确的是( )
| A. | 非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数 | |
| B. | 非金属元素呈现的最高化合价不超过该元素原子的最外层电子数 | |
| C. | 最外层有2个电子的原子都是金属原子 | |
| D. | 金属元素只有正价和零价,而非金属元素既有正价又有负价又有零价 |
3.体积相同的甲、乙两个容器中,分别都充有等物质的量的SO3,在相同温度下发生反应:2SO3(g)?2SO2(g)+O2(g),并达到平衡.在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO3的转化率为p%,则乙容器中SO3的转化率( )
| A. | 等于p% | B. | 大于p% | C. | 小于p | D. | 无法判断 |
10.下列有关实验操作的叙述中正确的是( )
| A. |  利用甘油密度大于乙醇且更易溶于水,进行甘油与乙醇的混合物分离 | |
| B. | 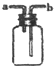 进行H2,NH3,CO2,Cl2,HCl,NO2等气体收集,也能用于NO气体收集 | |
| C. |  当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 | |
| D. | 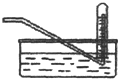 常用于实验室收集氧气、氢气等 |
7.现有:①0.1mol•L-1醋酸溶液,②0.1mol•L-1盐酸,③pH=1的醋酸溶液.分别加水稀释,使体积变为原来的10倍.对于稀释前后溶液的有关说法错误的是[说明:pH=-lgc(H+)]( )
| A. | 稀释前,溶液pH:①>②=③ | |
| B. | 稀释后,溶液pH:①>②=③ | |
| C. | 稀释前,溶液中溶质的物质的量浓度:③>①=② | |
| D. | 稀释后,溶液中溶质的物质的量浓度:③>①=② |
8.短周期元素X的气态氢化物的化学式为H2X,X所在的族是( )
| A. | ⅡA族 | B. | ⅣA族 | C. | Ⅵ族 | D. | ⅥA族 |