题目内容
13.碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如图: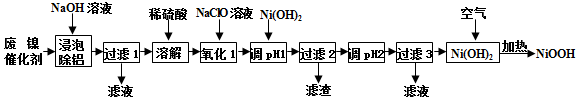
回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;
(2)“溶解”时放出的气体为H2、H2S (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr3+ | 4.5 | 5.6 |
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O;
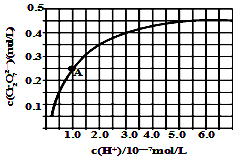
(5)金属铬在溶液中有多种存在形式,CrO42-和Cr2O72-在溶液中可相互转化.室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应2CrO42-+2H+?Cr2O72-+H2O,根据A点数据计算出该转化反应的平衡常数为1014,温度升高,溶液中CrO42-的平衡转化率减小,则该反应的△H<0(填“>”、“<”或“=”).
分析 由流程可知,废镍催化剂(主要含Ni、Al,少量Cr、FeS等)加氢氧化钠碱浸,Al溶解:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,过滤得到固体含有Ni、Cr、FeS,加入稀硫酸酸浸溶解,溶液含有Ni2+、Fe2+、Cr2+,加入NaClO氧化亚铁离子为铁离子,加入Ni(OH)2调节溶液PH使Fe3+和Cr2+全部沉淀,镍离子不沉淀,过滤后调节溶液PH得到Ni(OH)2沉淀,通过蒸发浓缩,冷却结晶,过滤洗涤得到NiSO4•7H2O晶体,在加热条件下与空气反应得到碱式氧化镍(NiOOH),以此解答(1)~(4);
(5)图象分析可知随氢离子浓度增大,铬酸根离子转化为重铬酸根离子;A点c(Cr2O72-)=0.25mol/L,c(H+)=10-7mol/L,c(CrO42-)=0.5mol/L,依据平衡常数概念计算,K=$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}({H}^{+}){c}^{2}(Cr{{O}_{4}}^{2-})}$;
溶液酸性增大,平衡2CrO42-+2H+?Cr2O72-+H2O正向进行,CrO42-的平衡转化率增大;A点Cr2O72-的浓度为0.25mol/L,则消耗的CrO42-的浓度为0.5mol/L,则溶液中的c(CrO42-)=1.0mol/L-0.25mol/L×2=0.5mol/L,H+浓度为1×10-7mol/L,计算反应的平衡常数;
升高温度,溶液中CrO42-的平衡转化率减小,平衡逆向移动.
解答 解:(1)“浸泡除铝”时,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(2)“溶解”时为Ni、Cr、FeS与稀硫酸反应,Ni+H2SO4═NiSO4+H2↑、Cr+H2SO4═CrSO4+H2↑、FeS+H2SO4═NiSO4+H2S↑;
故答案为:H2、H2S;
(3)加入Ni(OH)2调节溶液PH使Fe3+和Cr2+全部沉淀,镍离子不沉淀,故pH范围为5.6~6.2;
故答案为:5.6~6.2;
(4)在加热条件下Ni(OH)2与空气反应得到碱式氧化镍(NiOOH),化学方程式为:4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O;
故答案为:4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O;
(5)随着H+浓度的增大,CrO42-转化为Cr2O72-的离子反应式为:2CrO42-+2H+?Cr2O72-+H2O,
溶液酸性增大,平衡2CrO42-+2H+?Cr2O72-+H2O正向进行,CrO42-的平衡转化率增大;A点Cr2O72-的浓度为0.25mol/L,则消耗的CrO42-的浓度为0.5mol/L,则溶液中的c(CrO42-)=1.0mol/L-0.25mol/L×2=0.5mol/L,H+浓度为1×10-7mol/L,此时该转化反应的平衡常数为 K=$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}({H}^{+}){c}^{2}(Cr{{O}_{4}}^{2-})}$=$\frac{0.25}{0.{5}^{2}×(1{0}^{-7})^{2}}$=1.0×1014,
升高温度,溶液中CrO42-的平衡转化率减小,平衡逆向移动,说明正方向放热,则该反应的△H<0,
故答案为:2CrO42-+2H+?Cr2O72-+H2O;1014;<.
点评 本题考查了物质分离方法和实验过程分析判断,为高考常见题型,侧重离子方程式的书写和氧化还原反应的计算应用,注意流程的理解以及平衡常数的理解应用,题目有利于培养学生的实验能力和计算能力,难度中等.

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案| A. | 铵态氮肥和草木灰混合使用可增加肥效 | |
| B. | 氢氟酸刻蚀水晶饰品体现其酸性 | |
| C. | 电渗析法、蒸馏法、离子交换法是海水淡化的常用方法 | |
| D. | 煤经过气化和液化等物理变化可转为清洁能源 |
| A. | 1.25g | B. | 1.32g | C. | 1.97g | D. | 2.44g |
| A. | 邻甲基苯甲酸( 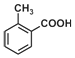 )含有苯环且属于酯类的同分异构体有5种 )含有苯环且属于酯类的同分异构体有5种 | |
| B. | CH3-CH=CH-CH2-CH3中最多有9个原子在同一平面上 | |
| C. | 有机物 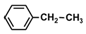 在一定条件下与足量H2加成,所得产物的一氯代物有5种 在一定条件下与足量H2加成,所得产物的一氯代物有5种 | |
| D. | 可以用裂化汽油萃取溴水中的溴 |
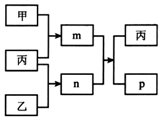 短周期主族元素X、Y、Z、W的原子序数依次增大.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙易溶于YW2,n为二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法一定正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙易溶于YW2,n为二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法一定正确的是( )| A. | 原子半径:X<Y<Z | |
| B. | 最简单氢化物的沸点:Z>W>Y | |
| C. | W的氧化物的水化物为强酸 | |
| D. | 常温常压下,X与Y组成的化合物为气体 |
| A. | 放电时正极上的电极反应为:V2O4+xe-+xLi+=LixV2O4 | |
| B. | 该充电宝的凝胶介质也可用KOH溶液代替 | |
| C. | 充电时电池的正极得到电子后LixV2O4转化为V2O4 | |
| D. | 放电时每消耗7gLi,就会有1mol电子通过凝胶 |
| A. | 化学反应必然伴随发生能量变化 | |
| B. | 化学反应中的能量变化主要是由化学键变化引起的 | |
| C. | 反应物的总能量与生成物的总能量一定相等 | |
| D. | 化学反应中既有物质变化又有能量变化 |

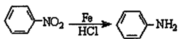 ,-NH2易被强氧化剂氧化
,-NH2易被强氧化剂氧化
 .
.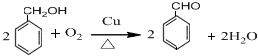 .
.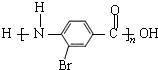 .
.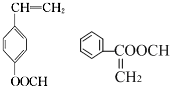 .
.