题目内容
18.下列说法正确的是( )| A. | 邻甲基苯甲酸( 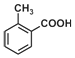 )含有苯环且属于酯类的同分异构体有5种 )含有苯环且属于酯类的同分异构体有5种 | |
| B. | CH3-CH=CH-CH2-CH3中最多有9个原子在同一平面上 | |
| C. | 有机物 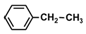 在一定条件下与足量H2加成,所得产物的一氯代物有5种 在一定条件下与足量H2加成,所得产物的一氯代物有5种 | |
| D. | 可以用裂化汽油萃取溴水中的溴 |
分析 A、据有机物属于酯类,且分子结构中有苯环,则应含有-COO-官能团,则取代基分别为-CH3和-OOCH或-OOCCH3或-COOCH3或-CH2OOCH,有2个取代基时,有邻、间、对三不同结构;
B、CH3-CH=CH-CH2-CH3可以认为是用一个甲基和一个乙基分别取代了乙烯中的一个H原子而得到;
C、 在一定条件下与足量H2完全加成生成
在一定条件下与足量H2完全加成生成 ,环上有4种H,侧链有2种H;
,环上有4种H,侧链有2种H;
D、裂化汽油中含烯烃.
解答 解:A、由题目要求可知该有机物的同分异构体中应具有CH3-C6H4-OOCH(-C6H4-为苯环)的结构,应有邻、间、对三种同分异构体或C6H5-OOCCH3或C6H5-COOCH3或C6H5-CH2OOCH共6种,故A错误;
B、CH3-CH=CH-CH2-CH3可以认为是用一个甲基和一个乙基分别取代了乙烯中的一个H原子而得到,故1号碳原子、2号碳原子以及2号碳原子上所连的H原子、3号碳原子以及3号碳原子上所连的H原子、4号碳原子这6个原子一定共平面,而1号碳原子上最多有1个H原子也可能共平面,5号碳原子和5号碳原子上最多有一个H原子也可能与此平面共平面,故此有机物中最多有9个原子共平面,故B正确;
C、 在一定条件下与足量H2完全加成生成
在一定条件下与足量H2完全加成生成 ,环上有4种H,侧链有2种H,如图
,环上有4种H,侧链有2种H,如图 ,共6种H,则所得产物的一氯代物有6种,故C错误;
,共6种H,则所得产物的一氯代物有6种,故C错误;
D、裂化汽油中含烯烃,故和溴水发生加成反应,故不能用于萃取溴水中的溴,故D错误.
故选B.
点评 本题考查了同分异构体的书写和以乙烯为母体的原子共平面问题的判断,难度适中,应注意同分异构体书写方法,是高考中的常考点和难点.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
4.氯水是化学实验室中常用的一种试剂,下列有关该试剂的说法错误的是( )
| A. | 氯水显酸性的主要原因:HClO?H++ClO- | |
| B. | 向氯水中滴加少量NaHCO3溶液:H++HCO3-═CO2↑+H2O | |
| C. | SO2具有漂白性,向氯水中通入少量SO2,溶液的漂白能力降低 | |
| D. | 常温时,氯水中含有的阴离子:Cl-、ClO-、OH- |
13.碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如图:
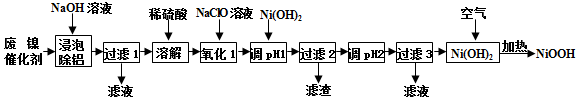
回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;
(2)“溶解”时放出的气体为H2、H2S (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
“调pH=1”时,溶液pH范围为5.6~6.2;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O;
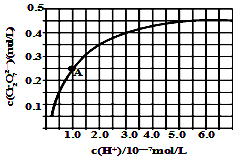
(5)金属铬在溶液中有多种存在形式,CrO42-和Cr2O72-在溶液中可相互转化.室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应2CrO42-+2H+?Cr2O72-+H2O,根据A点数据计算出该转化反应的平衡常数为1014,温度升高,溶液中CrO42-的平衡转化率减小,则该反应的△H<0(填“>”、“<”或“=”).

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;
(2)“溶解”时放出的气体为H2、H2S (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr3+ | 4.5 | 5.6 |
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O;
(5)金属铬在溶液中有多种存在形式,CrO42-和Cr2O72-在溶液中可相互转化.室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应2CrO42-+2H+?Cr2O72-+H2O,根据A点数据计算出该转化反应的平衡常数为1014,温度升高,溶液中CrO42-的平衡转化率减小,则该反应的△H<0(填“>”、“<”或“=”).

3.已知W、X、Y、Z为短周期元素,原子序数依次增大.W、Z同主族,X、Y、Z同周期,其中只有X为金属元素.下列说法一定正确的是( )
| A. | W的含氧酸的酸性比Z的含氧酸的酸性强 | |
| B. | 原子半径:X>Y>Z>W | |
| C. | W的气态氢化物的稳定性小于Y的气态氢化物的稳定性 | |
| D. | 若W与X原子序数差为5,则形成化合物的化学式为X3W2 |
10.化学在工业生产、建筑建材、食品、药品等方面均有重要的作用,下列有关叙述不正确的是( )
| A. | 煤干馏后得到的焦炉煤气主要含有甲烷、氢气、乙烯和一氧化碳等 | |
| B. | 生活中常见的有机玻璃的主要成分是聚甲基丙烯酸甲酯,它是一种有机聚合物 | |
| C. | 阿斯匹林、去痛片等药片是用淀粉作为粘合材料压制而成的片剂 | |
| D. | 成熟苹果的汁液能与银氨溶液发生反应,是因为苹果中含有大量的淀粉和纤维素 |
7.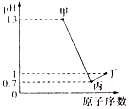 X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁.常温下甲、丙、丁均可与乙反应生成盐和水,Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁.常温下甲、丙、丁均可与乙反应生成盐和水,Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
 X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁.常温下甲、丙、丁均可与乙反应生成盐和水,Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁.常温下甲、丙、丁均可与乙反应生成盐和水,Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )| A. | 简单阴离子的还原性:Z<W | |
| B. | Y、Z的简单离子都会影响水的电离平衡 | |
| C. | 乙固体中加入甲的溶液或浓氨水,固体都能溶解 | |
| D. | X、Y分别与W形成的化合物皆为离子化合物 |
16.下列叙述不正确的是( )
| A. | 100℃纯水的pH<7,此时水仍呈中性 | |
| B. | pH=3的醋酸溶液,稀释至100倍后pH小于5 | |
| C. | 0.2 mol/L的盐酸,与等体积水混合后pH=1 | |
| D. | pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
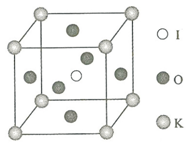 钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用.回答下列问题:
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用.回答下列问题: