题目内容
8.一定体积的CH4在密闭容器中与一定量的氧气燃烧后得到的产物为CO、CO2和水蒸气,此混合气重4.96g,当其缓慢经过浓硫酸时,浓硫酸增重2.52g.原混合气体中CO2的质量为( )| A. | 1.25g | B. | 1.32g | C. | 1.97g | D. | 2.44g |
分析 CH4燃烧产物为CO、CO2、H2O(g),产物通过浓硫酸时,浓硫酸的作用是吸收水分,浓硫酸增重2.52g为水的质量,根据H原子守恒可计算CH4的物质的量,根据C原子守恒可计算CO和CO2的总的物质的量,再根据二者质量可计算CO2的物质的量,进而计算CO2质量.
解答 解:当其产物缓慢经过浓硫酸时,浓硫酸增重2.52g为水的质量,
所以n(H2O)=$\frac{2.52g}{18g/mol}$=0.14mol,
根据H原子守恒,可知:n(CH4)=$\frac{1}{2}$n(H2O)=$\frac{1}{2}$×0.14mol=0.07mol,
根据C原子守恒,则:n(CO)+n(CO2)=0.07mol,
所以m(CO)+m(CO2)=4.96g-2.52g=2.44g,
所以[0.07mol-n(CO2)]×28g/mol+n(CO2)×44g/mol=2.44g,
解之:n(CO2)=0.03mol,
所以生成二氧化碳的质量为0.03mol×44g/mol=1.32g.
故选B.
点评 本题考查混合物的计算,题目难度中等,注意从原子守恒的角度解答,关键根据水的质量判断甲烷的物质的量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用.
(1)工业生产纯碱的第一步是除去饱和食盐水的中Mg2+、Ca2+离子,从成本角度考虑加入试剂的化学式为Ca(OH)2、Na2CO3.
某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如图1: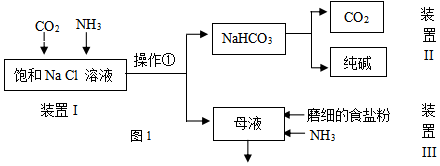
已知:几种盐的溶解度
(2)①写出装置I中反应的化学方程式NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl.
②从平衡移动角度解释该反应发生的原因在溶液中存在下述两种平衡NH3+H2O?NH3•H2O?NH4++OH-,CO2+H2O?H2CO3?H++HCO3-,OH-与H+结合生成水,促进两平衡正向移动,使溶液中的NH4+和HCO3-浓度均增大,由于NaHCO3溶解度小,因此HCO3-与Na+结合生成NaHCO3,固体析出使得反应发生.
③操作①的名称是过滤.
(3)写出装置II中发生反应的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(4)请结合化学用语说明装置III中加入磨细的食盐粉及NH3的作用.在母液中含有大量的NH4+和Cl-,存在平衡NH4Cl(s)?NH4++Cl-,通入氨气增大NH4+的浓度,加入磨细的食盐粉,增大Cl-的浓度,使上述平衡逆向移动,促使氯化铵结晶析出
(5)该流程中可循环利用的物质是氯化钠和二氧化碳
(6)制出的纯碱中含有杂质NaCl,为测定其纯度,下列方案中不可行的是c.
a.向m克纯碱样品中加入足量CaCl2溶液,测生成CaCO3的质量
b.向m克纯碱样品中加入足量稀H2SO4,干燥后测生成气体的体积
c.向m克纯碱样品中加入足量AgNO3溶液,测生成沉淀的质量.
(1)工业生产纯碱的第一步是除去饱和食盐水的中Mg2+、Ca2+离子,从成本角度考虑加入试剂的化学式为Ca(OH)2、Na2CO3.
某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如图1:

已知:几种盐的溶解度
| NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
| 溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
②从平衡移动角度解释该反应发生的原因在溶液中存在下述两种平衡NH3+H2O?NH3•H2O?NH4++OH-,CO2+H2O?H2CO3?H++HCO3-,OH-与H+结合生成水,促进两平衡正向移动,使溶液中的NH4+和HCO3-浓度均增大,由于NaHCO3溶解度小,因此HCO3-与Na+结合生成NaHCO3,固体析出使得反应发生.
③操作①的名称是过滤.
(3)写出装置II中发生反应的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(4)请结合化学用语说明装置III中加入磨细的食盐粉及NH3的作用.在母液中含有大量的NH4+和Cl-,存在平衡NH4Cl(s)?NH4++Cl-,通入氨气增大NH4+的浓度,加入磨细的食盐粉,增大Cl-的浓度,使上述平衡逆向移动,促使氯化铵结晶析出
(5)该流程中可循环利用的物质是氯化钠和二氧化碳
(6)制出的纯碱中含有杂质NaCl,为测定其纯度,下列方案中不可行的是c.
a.向m克纯碱样品中加入足量CaCl2溶液,测生成CaCO3的质量
b.向m克纯碱样品中加入足量稀H2SO4,干燥后测生成气体的体积
c.向m克纯碱样品中加入足量AgNO3溶液,测生成沉淀的质量.
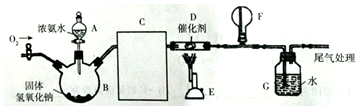
14.化学是建立在实验基础上的学科.关于下列各实验装置的叙述中,不正确的是( )

| A. | 装置①可用于实验室制取少量 NH3或 O2 | |
| B. | 可用从 a 处加水的方法检验装置②的气密性 | |
| C. | 实验室可用装置③收集 H2、NH3 | |
| D. | 利用装置④制硫酸和氢氧化钠,其中 b 为阳离子交换膜、c 为阴离子交换膜 |
3.合理利用燃料减小污染符合“绿色化学”理念,下列关于燃料的说法正确的是( )
| A. | “可燃冰”是将水变为油的新型燃料 | |
| B. | 氢气是具有热值高、无污染等优点的燃料 | |
| C. | 天然气、海洋能、太阳能、生物质能、风能、氢能 都属于新能源 | |
| D. | 电能是一次能源 |
13.碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如图:
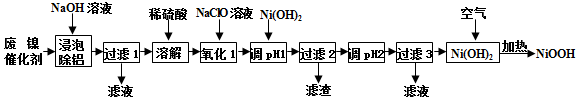
回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;
(2)“溶解”时放出的气体为H2、H2S (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
“调pH=1”时,溶液pH范围为5.6~6.2;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O;
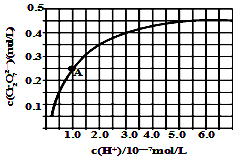
(5)金属铬在溶液中有多种存在形式,CrO42-和Cr2O72-在溶液中可相互转化.室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应2CrO42-+2H+?Cr2O72-+H2O,根据A点数据计算出该转化反应的平衡常数为1014,温度升高,溶液中CrO42-的平衡转化率减小,则该反应的△H<0(填“>”、“<”或“=”).

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;
(2)“溶解”时放出的气体为H2、H2S (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr3+ | 4.5 | 5.6 |
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O;
(5)金属铬在溶液中有多种存在形式,CrO42-和Cr2O72-在溶液中可相互转化.室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应2CrO42-+2H+?Cr2O72-+H2O,根据A点数据计算出该转化反应的平衡常数为1014,温度升高,溶液中CrO42-的平衡转化率减小,则该反应的△H<0(填“>”、“<”或“=”).

20.乙醇中的化学键如图,则下列说法中正确的是( )
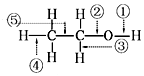

| A. | 当乙醇发生催化氧化时,被破坏的键是②③ | |
| B. | 当乙醇与Na反应时,被破坏的键是① | |
| C. | 当乙醇与乙酸反应时,被破坏的键是② | |
| D. | 当乙醇发生催化氧化时,被破坏的键是①④ |
17.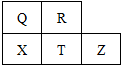 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )| A. | 五种元素中Z的活动性最弱,T 的最高价氧化物对应水化合物酸性最强 | |
| B. | 氢化物的稳定性:R>Q>X;R>T>X | |
| C. | Q单质能从溶液中置换出X单质,R单质能从溶液中置换出Q单质 | |
| D. | X阴离子和T阴离子相比,半径:X阴离子的大;还原性:T阴离子的强 |

 .
.  .
. $→_{K_{2}CO_{3}}^{(CH_{3})_{2}SO_{4}}$
$→_{K_{2}CO_{3}}^{(CH_{3})_{2}SO_{4}}$ (R代表烃基,R'代表烃基或H) 请写出以
(R代表烃基,R'代表烃基或H) 请写出以 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).