��Ŀ����
7��ˮ���ܽ�����ˮ���������治��ȱ�ٵ�������ij����С����õ������ⶨѧУ�ܱߺ�ˮ�е��ܽ�����ʵ�鲽�輰�ⶨԭ�����£���ȡ�������Ĺ̶�
���ܽ���ƿ�ɼ�ˮ������¼����ѹ��ˮ���¶ȣ���ˮ����Mn��OH��2��������Һ������KI����ϣ���Ӧ����MnO��OH��2��ʵ�����Ĺ̶���
���ữ���ζ�
���������ˮ���ữ��MnO��OH��2��I-��ԭΪMn2+���ڰ�������5min��Ȼ���ñ�Na2S2O3��Һ�ζ����ɵ�I2��2S2O32-+I2=2I-+S4O62-����
�ش��������⣺
��1��ȡˮ��ʱӦ���������Ŷ�ˮ����棬������������ҪĿ����ʹ�ⶨֵ��ˮ���е�ʵ��ֵ����һ�£����������
��2�������Ĺ̶����з�����Ӧ�Ļ�ѧ����ʽΪ2Mn��OH��2+O2=2MnO��OH��2��
��3��Na2S2O3��Һ���ȶ���ʹ��ǰ��궨�����Ƹ���Һʱ��Ҫ�IJ����������ձ������������Լ�ƿ��һ���ݻ�������ƿ����ͷ�ιܡ���Ͳ������ˮ���뾭����С���ȴ�����ʹ�ã���Ŀ����ɱ������������������̼��
��4��ȡ100.00mLˮ�����������ữ����a mol•L-1Na2S2O3��Һ�ζ����Ե�����Һ��ָʾ�����յ�����Ϊ���������һ��ʱ����Һ����ɫ��Ϊ��ɫ���Ұ�������ޱ仯��������Na2S2O3��Һ�����Ϊb mL����ˮ�����ܽ����ĺ���Ϊ80abmg•L-1��
��5�������ζ����ʱ�����ζ��ܼ��촦�������ݻᵼ�²������ƫ�ͣ�����ߡ��͡���
���� ��1���ɼ���ˮ�����ܽ������������������ر����¶Ⱥ�ѹǿ���ı����ܽ�ȷ����ı䣻
��2�������Ĺ̶����ķ����ǣ���Mn��OH��2��������Һ������KI����ˮ����ϣ���Ӧ����MnO��OH��2��ʵ�����Ĺ̶���
��3�����ʵ���Ũ�ȵ�����ʵ�飬ʹ�õ������У��ձ�����������һ���ݻ�������ƿ����ͷ�ιܡ���Ͳ����ˮ���е������ʱ���ʹ�õ�����ˮ�ܽ�������
��4���������۱���ɫ����ѡ�������ָʾ��������Һ����ɫ��Ϊ��ɫ���Ұ������ɫ���ٱ仯˵���ζ������յ㣻���ݷ���ʽ�� I2��S2O32-֮��Ĺ�ϵʽ���㣻
��5������n��O2��=$\frac{b��1{0}^{-3}��a}{4}$mol����������������b��Ӱ�죬�Դ��жϲ����������
��� �⣺��1��ȡˮ��ʱ�Ŷ�ˮ����棬����������ʹ�����ܽ�ȼ�С��Ϊ�ˣ�ȡˮ��ʱӦ���������Ŷ�ˮ����棬������������ҪĿ����ʹ�ⶨֵ��ˮ���е�ʵ��ֵ����һ�£����������
�ʴ�Ϊ��ʹ�ⶨֵ��ˮ���е�ʵ��ֵ����һ�£����������
��2�������Ĺ̶����з�����Ӧ�Ļ�ѧ����ʽΪ��2Mn��OH��2+O2=2MnO��OH��2��
�ʴ�Ϊ��2Mn��OH��2+O2=2MnO��OH��2��
��3������ˮ���뾭����С���ȴ�����ʹ�ã���Ŀ����ɱ������������������̼��
�ʴ�Ϊ��������
��4���������۱���ɫ����ѡ�������ָʾ��������Һ����ɫ��Ϊ��ɫ���Ұ������ɫ���ٱ仯˵���ζ������յ㣻���ݷ���ʽ��O2��2I2��4S2O32-��n��O2��=$\frac{b��1{0}^{-3}��a}{4}$mol��m��O2��=$\frac{b��1{0}^{-3}��a}{4}mol��32g/mol$=8abmg����ˮ�����ܽ����ĺ���Ϊ��$\frac{8abmg}{0.1L}$=80abmg��L-1��
�ʴ�Ϊ�����������һ��ʱ����Һ����ɫ��Ϊ��ɫ���Ұ�������ޱ仯��80abmg��L-1��
��5������n��O2��=$\frac{b��1{0}^{-3}��a}{4}$mol����������������b��Ӱ�죬bֵ��С����ᵼ�²������ƫ�ͣ�
�ʴ�Ϊ���ͣ�
���� ������Ҫ�������������ӵļ��ʵ����Ƽ���ζ����ⶨ�����Ĺ��̣��й���ϢӦ�úͻ�ѧ����ʽ�ļ��㣬ʵ�鲽���ж��ǽ���ؼ�����Ŀ�Ѷ��еȣ�

 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д�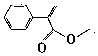 ������˵����ȷ���ǣ�������
������˵����ȷ���ǣ�������| A�� | ����������ڼ����������ױ��� | |
| B�� | �����ᣨ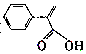 ������������̼ԭ�Ӳ����ܹ�ƽ�� ������������̼ԭ�Ӳ����ܹ�ƽ�� | |
| C�� | ���������ʹ��ˮ��ɫ�ķ�Ӧ����ȡ����Ӧ | |
| D�� | �������������ʽΪC10H8O2 |
| A�� | ������̼ʹNa2O2������ | B�� | ����ʹKBr��Һ��� | ||
| C�� | ��ϩʹBr2�����Ȼ�̼��Һ��ɫ | D�� | ����ʹAlCl3��Һ������ɫ���� |
 ���������Ǵ�ͳ�в�ҩ���˵���Ч�ɷ�֮һ��������ϸ����ɱ���ж������ã������йغ������ص�������ȷ���ǣ�������
���������Ǵ�ͳ�в�ҩ���˵���Ч�ɷ�֮һ��������ϸ����ɱ���ж������ã������йغ������ص�������ȷ���ǣ�������| A�� | �������صķ���ʽΪC16H13O5 | |
| B�� | ��������FeCl3��Һ��ɫ | |
| C�� | 1 mol����������ˮ��Ӧ���������1mol Br2 | |
| D�� | ������H2�����ӳɷ�Ӧ�÷����й����ŵ��������1�� |
��1����ҵ��������ĵ�һ���dz�ȥ����ʳ��ˮ����Mg2+��Ca2+���ӣ��ӳɱ��Ƕȿ��Ǽ����Լ��Ļ�ѧʽΪCa��OH��2��Na2CO3��
ijʵ��С���ͬѧģ���°��Ƽ��ȡ���������ͼ1��
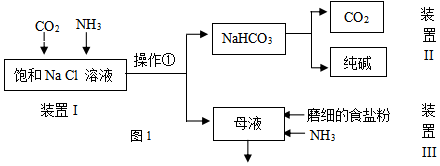
��֪�������ε��ܽ��
| NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
| �ܽ�ȣ�20��C��100gH2Oʱ�� | 36.0 | 21.7 | 9.6 | 37.2 |
�ڴ�ƽ���ƶ��ǶȽ��÷�Ӧ������ԭ������Һ�д�����������ƽ��NH3+H2O?NH3•H2O?NH4++OH-��CO2+H2O?H2CO3?H++HCO3-��OH-��H+�������ˮ���ٽ���ƽ�������ƶ���ʹ��Һ�е�NH4+��HCO3-Ũ�Ⱦ���������NaHCO3�ܽ��С�����HCO3-��Na+�������NaHCO3����������ʹ�÷�Ӧ������
�۲����ٵ������ǹ��ˣ�
��3��д��װ��II�з�����Ӧ�Ļ�ѧ����ʽ2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2����
��4�����ϻ�ѧ����˵��װ��III�м���ĥϸ��ʳ�ηۼ�NH3�����ã���ĸҺ�к��д�����NH4+��Cl-������ƽ��NH4Cl��s��?NH4++Cl-��ͨ�백������NH4+��Ũ�ȣ�����ĥϸ��ʳ�ηۣ�����Cl-��Ũ�ȣ�ʹ����ƽ�������ƶ�����ʹ�Ȼ�什ᾧ����
��5���������п�ѭ�����õ��������Ȼ��ƺͶ�����̼
��6���Ƴ��Ĵ����к�������NaCl��Ϊ�ⶨ�䴿�ȣ����з����в����е���c��
a����m�˴�����Ʒ�м�������CaCl2��Һ��������CaCO3������
b����m�˴�����Ʒ�м�������ϡH2SO4��������������������
c����m�˴�����Ʒ�м�������AgNO3��Һ�������ɳ�����������
| A�� | �����趨�յ��¶Ⱦ����ܵĵ� | B�� | �ƹ�ʹ��һ�������ϴ���ֽ�� | ||
| C�� | �ٿ�˽�ҳ���˹�����ͨ���� | D�� | ����Ʒ���к�����װ�ٽ����� |
| A�� | �ȶ��ԣ�NH3��H2O��HF | B�� | ���Ӱ뾶��Na+��Mg2+��Al3+ | ||
| C�� | ���ԣ�HClO4��H2SO4��H2CO3 | D�� | ������ԭ�ԣ�Mg��Ca |
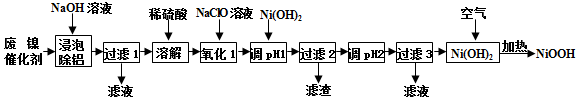
�ش��������⣺
��1�������ݳ�����ʱ��������Ӧ�����ӷ�Ӧ����ʽΪ2Al+2OH-+2H2O�T2AlO2-+3H2����
��2�����ܽ⡱ʱ�ų�������ΪH2��H2S ���ѧʽ����
��3����֪�������½������ӿ�ʼ��������ȫ������pH�����
| ��ʼ������pH | ��ȫ������pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr3+ | 4.5 | 5.6 |
��4���ڿ����м���Ni��OH��2�ɵ�NiOOH����д���˷�Ӧ�Ļ�ѧ����ʽ4Ni��OH��2+O2$\frac{\underline{\;\;��\;\;}}{\;}$4NiOOH+2H2O��
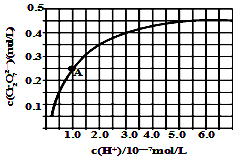
��5������������Һ���ж��ִ�����ʽ��CrO42-��Cr2O72-����Һ�п��ת���������£���ʼŨ��Ϊ1.0mol/L��Na2CrO4��Һ��c��Cr2O72-����c��H+���ı仯��ͼ��ʾ�������ӷ���ʽ��ʾNa2CrO4��Һ�е�ת����Ӧ2CrO42-+2H+?Cr2O72-+H2O������A�����ݼ������ת����Ӧ��ƽ�ⳣ��Ϊ1014���¶����ߣ���Һ��CrO42-��ƽ��ת���ʼ�С����÷�Ӧ�ġ�H��0�����������������=������
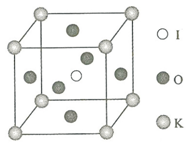 �غ͵����ػ������ڻ�����ҽҩ�����ϵ��������Ź㷺��Ӧ�ã��ش��������⣺
�غ͵����ػ������ڻ�����ҽҩ�����ϵ��������Ź㷺��Ӧ�ã��ش��������⣺