题目内容
5.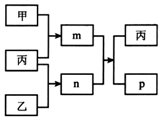 短周期主族元素X、Y、Z、W的原子序数依次增大.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙易溶于YW2,n为二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法一定正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙易溶于YW2,n为二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法一定正确的是( )| A. | 原子半径:X<Y<Z | |
| B. | 最简单氢化物的沸点:Z>W>Y | |
| C. | W的氧化物的水化物为强酸 | |
| D. | 常温常压下,X与Y组成的化合物为气体 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙易溶于YW2,可知丙为S,YW2为CS2,可知,Y为C,W为S,n为二元弱酸,则n为H2S,结合图中转化可知,甲为O2,m为SO2,乙为H2,m与n反应生成S和水,则p为H2O,结合原子序数可知,X为H,Z为O,以此来解答.
解答 解:由上述分析可知,X为H,Y为C,Z为O,W为S,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:X<Z<Y,故A错误;
B.非金属性O>S>C,则最简单氢化物的沸点:Z>W>Y,故B正确;
C.W的氧化物的水化物若为亚硫酸,为弱酸,故C错误;
D.常温常压下,X与Y组成的化合物若为苯,为液体,故D错误;
故选B.
点评 本题考查无机物的推断及原子结构与元素周期律,为高频考点,把握图中转化关系、元素化合物知识来推断元素、物质为解答的关键,侧重分析与推断能力的考查,注意S易溶于二氧化碳及含硫化合物的转化为推断的突破口,选项D为易错点,题目难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
19.2017 年世界地球日我国的主题为“节约集约利用资源,倡导绿色简约生活”.下列做法应提倡的是( )
| A. | 夏天设定空调温度尽可能的低 | B. | 推广使用一次性塑料袋和纸巾 | ||
| C. | 少开私家车多乘公共交通工具 | D. | 对商品进行豪华包装促进销售 |
13.碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如图:
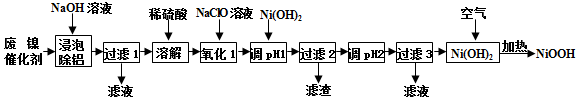
回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;
(2)“溶解”时放出的气体为H2、H2S (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
“调pH=1”时,溶液pH范围为5.6~6.2;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O;
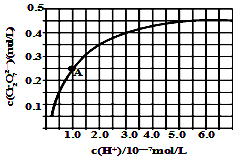
(5)金属铬在溶液中有多种存在形式,CrO42-和Cr2O72-在溶液中可相互转化.室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应2CrO42-+2H+?Cr2O72-+H2O,根据A点数据计算出该转化反应的平衡常数为1014,温度升高,溶液中CrO42-的平衡转化率减小,则该反应的△H<0(填“>”、“<”或“=”).

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;
(2)“溶解”时放出的气体为H2、H2S (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr3+ | 4.5 | 5.6 |
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O;
(5)金属铬在溶液中有多种存在形式,CrO42-和Cr2O72-在溶液中可相互转化.室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应2CrO42-+2H+?Cr2O72-+H2O,根据A点数据计算出该转化反应的平衡常数为1014,温度升高,溶液中CrO42-的平衡转化率减小,则该反应的△H<0(填“>”、“<”或“=”).

20.乙醇中的化学键如图,则下列说法中正确的是( )
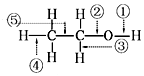

| A. | 当乙醇发生催化氧化时,被破坏的键是②③ | |
| B. | 当乙醇与Na反应时,被破坏的键是① | |
| C. | 当乙醇与乙酸反应时,被破坏的键是② | |
| D. | 当乙醇发生催化氧化时,被破坏的键是①④ |
10.化学在工业生产、建筑建材、食品、药品等方面均有重要的作用,下列有关叙述不正确的是( )
| A. | 煤干馏后得到的焦炉煤气主要含有甲烷、氢气、乙烯和一氧化碳等 | |
| B. | 生活中常见的有机玻璃的主要成分是聚甲基丙烯酸甲酯,它是一种有机聚合物 | |
| C. | 阿斯匹林、去痛片等药片是用淀粉作为粘合材料压制而成的片剂 | |
| D. | 成熟苹果的汁液能与银氨溶液发生反应,是因为苹果中含有大量的淀粉和纤维素 |
17.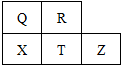 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )| A. | 五种元素中Z的活动性最弱,T 的最高价氧化物对应水化合物酸性最强 | |
| B. | 氢化物的稳定性:R>Q>X;R>T>X | |
| C. | Q单质能从溶液中置换出X单质,R单质能从溶液中置换出Q单质 | |
| D. | X阴离子和T阴离子相比,半径:X阴离子的大;还原性:T阴离子的强 |
3.12.8gCu与足量浓硝酸反应,铜完全反应后,产生气体在标况下的体积为 4.48L,则消耗硝酸的物质的量为( )
| A. | 0.20mol | B. | 0.40mol | C. | 0.42mol | D. | 0.60m |

 .
.  .
. $→_{K_{2}CO_{3}}^{(CH_{3})_{2}SO_{4}}$
$→_{K_{2}CO_{3}}^{(CH_{3})_{2}SO_{4}}$ (R代表烃基,R'代表烃基或H) 请写出以
(R代表烃基,R'代表烃基或H) 请写出以 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).