题目内容
 常温下,用0.1000mol?L-1 NaOH溶液分别滴定20.00mL 0.1000mol?L-1 HA和HB溶液,得到2条滴定曲线,如下图所示(图1表示HA,图2表示HB),下列说洼正确的是( )
常温下,用0.1000mol?L-1 NaOH溶液分别滴定20.00mL 0.1000mol?L-1 HA和HB溶液,得到2条滴定曲线,如下图所示(图1表示HA,图2表示HB),下列说洼正确的是( )| A、HA是弱酸,HB是强酸 |
| B、达到E点时,对应混合溶液中c(Na+)=c(B-)+c(HB) |
| C、达到B、D点时,两溶液pH均为7,反应消耗的n(HA)=n(HB) |
| D、当达到E点后,继续滴加NaOH溶液,对应混合溶液中各离子浓度由大到小的顺序均为c(Na+)>c(B-)>c(OH-)>c(H+) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.HA、HB的浓度都是0.1000mol/L,根据A点和C点的pH可以判断二者酸性强弱;
B.根据图1判断a,然后根据图2E点滴入的氢氧化钠体积amL及物料守恒判断溶液中离子浓度关系;
C.根据HB为弱酸分析,若溶液pH=7,消耗的HB的物质的量小于HA.
D.当达到E点后,继续滴加NaOH溶液,溶液为HB和氢氧化钠的混合液,如果氢氧化钠远远过量,可能出现c(B-)<c(OH-).
B.根据图1判断a,然后根据图2E点滴入的氢氧化钠体积amL及物料守恒判断溶液中离子浓度关系;
C.根据HB为弱酸分析,若溶液pH=7,消耗的HB的物质的量小于HA.
D.当达到E点后,继续滴加NaOH溶液,溶液为HB和氢氧化钠的混合液,如果氢氧化钠远远过量,可能出现c(B-)<c(OH-).
解答:
解:A.根据图象可知,浓度为0.1000mol/L的HA、HB的pH分别为:1、3,则说明HA完全电离,为强酸,而HB部分电离,为弱酸,故A错误;
B.HA为强酸,图1中进入amL氢氧化钠溶液时溶液显示中性可知a=20mL;图2中E点氢氧化钠溶液体积与HB的体积相等,二者浓度也相等,根据物料守恒可知:c(Na+)=c(B-)+c(HB),故B正确;
C.达到B、D点时,两溶液的pH均为7,由于HA为强酸,则n(HA)=n(NaOH),HB为弱酸,溶液pH=7时,消耗的n(HB)<n(NaOH),所以反应消耗的n(HA)>n(HB),故C错误;
D.达到E点后,滴加氢氧化钠溶液,此时溶液为HB和NaOH的混合液,如果氢氧化钠加入到一定量,则可能出现:c(B-)<c(OH-),溶液中离子浓度关系为:c(Na+)>c(OH-)>c(B-)>c(H+),故D错误;
故选B.
B.HA为强酸,图1中进入amL氢氧化钠溶液时溶液显示中性可知a=20mL;图2中E点氢氧化钠溶液体积与HB的体积相等,二者浓度也相等,根据物料守恒可知:c(Na+)=c(B-)+c(HB),故B正确;
C.达到B、D点时,两溶液的pH均为7,由于HA为强酸,则n(HA)=n(NaOH),HB为弱酸,溶液pH=7时,消耗的n(HB)<n(NaOH),所以反应消耗的n(HA)>n(HB),故C错误;
D.达到E点后,滴加氢氧化钠溶液,此时溶液为HB和NaOH的混合液,如果氢氧化钠加入到一定量,则可能出现:c(B-)<c(OH-),溶液中离子浓度关系为:c(Na+)>c(OH-)>c(B-)>c(H+),故D错误;
故选B.
点评:本题考查了酸碱混合后定性判断及溶液pH与溶液酸碱性的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,根据图象判断电解质强弱是解答本题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
有关如图装置的说法中正确的是( )


| A、氧化剂与还原剂必须直接接触,才能发生反应 |
| B、乙池中电极反应式为NO3-+4H++e-═NO2↑+2H2O |
| C、当铜棒质量减少6.4g时,甲池溶液质量增加6.4g |
| D、当铜棒质量减少6.4g时,向乙池密封管中通入标准状况下1.12L O2,将使气体全部溶于水 |
解释下列事实的方程式正确的是( )
| A、加热可增强纯碱溶液去污力:CO32-+2H2O═H2CO3+2OH- |
| B、用稀硝酸洗涤做过银镜反应的试管:Ag+4H++NO3-═Ag++NO↑++2H2O |
| C、向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2═2CO2+2CaSO4 |
| D、碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀:HCO3-+Ca2++OH-═CaCO3↓+H2O |
下列过程的离子方程式正确的是( )
| A、用烧碱溶液吸收Cl2:Cl2+2OH-═Cl-+ClO-+H2O |
| B、用饱和Na2CO3溶液转化锅垢中的CaSO4:CaSO4(s)+CO32-(aq)═CaCO3(s)+SO42-(aq) |
| C、实验室制备Fe(OH)3胶体:Fe3++3OH-═Fe(OH)3↓ |
| D、金属Na与水反应:Na+2H+═H2↑+Na+ |

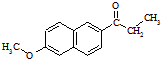 )外,最可能生成的副产物(与G互为同分异构体)的结构简式为
)外,最可能生成的副产物(与G互为同分异构体)的结构简式为 )的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰.写出X可能的结构简式:
)的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰.写出X可能的结构简式: 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).