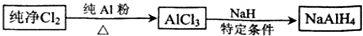题目内容
9.某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S.【查阅资料】经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.
【设计方案】学习小组设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
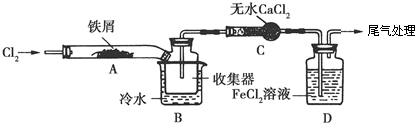
①检验装置的气密性;②通入干燥的Cl2,赶尽装置中的空气;③用酒精灯在铁屑下方加热至反应完成;④…;⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)Fe元素的原子结构示意图为
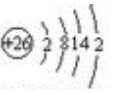 .FeCl3是共价化合物(填“离子”或“共价”).
.FeCl3是共价化合物(填“离子”或“共价”).(2)装置A中反应的化学方程式为2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3.
(3)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端.要使沉积的FeCl3进入收集器,第④步操作是在沉积的FeCl3固体下方加热.
(4)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)②⑤.
(5)装置B中冷水浴的作用为冷却使FeCl3沉积,便于收集产品;装置C的名称为干燥管;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂K3[Fe(CN)6]是配位化合物,其配位数为6,配体为CN?.
(6)该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;FeCl3与H2S反应的离子方程式为2Fe3++H2S═2Fe2++S↓+2H+.
分析 装置A中铁与氯气反应,反应为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品;为防止外界空气中的水蒸气进入装置使FeCl3潮解,所以用装置C无水氯化钙来吸水,装置D中用FeCl2吸收Cl2时的反应离子方程式2Fe2++Cl2═2Fe3++2Cl-,用装置D中的副产品FeCl3溶液吸收H2S,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,用氢氧化钠溶液吸收的是氯气,不用考虑防倒吸,所以装置E为氢氧化钠溶液吸收氯气.
(1)依据铁原子核内有26个质子,核外有4个电子层,从内到外依次容纳2,8,14,2个电子,据此书写原子结构示意图;一般的,电负性差值超过1.7,为离子化合物,否则为共价化合物;
(2)装置A中铁与氯气反应生成氯化铁;
(3)要使沉积的FeCl3进入收集器,根据FeCl3加热易升华的性质;
(4)防止FeCl3潮解,不与水蒸气接触;
(5)B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品;装置C的名称为干燥管;Fe[(CN)6]3-中CN-为配离子,则配离子的配位数是6;
(6)三价铁具有氧化性,硫化氢具有还原性,二者之间发生氧化还原反应.
解答 解:(1)铁原子核内有26个质子,核外有4个电子层,从内到外依次容纳2,8,14,2个电子,原子结构示意图: ;氯元素的电负性为3.16,铁元素为1.83,相差1.33.规定:一般的,电负性差值超过1.7,为离子化合物,否则为共价化合物. 因此,FeCl3是:共价化合物;
;氯元素的电负性为3.16,铁元素为1.83,相差1.33.规定:一般的,电负性差值超过1.7,为离子化合物,否则为共价化合物. 因此,FeCl3是:共价化合物;
故答案为: ;共价;
;共价;
(2)铁与氯气反应生成氯化铁,化学方程式:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(3)第③步加热后,生成的烟状FeCl3大部分进入收集器,第④步操作是对FeCl3加热发生升华使沉积的FeCl3进入收集器,
故答案为:在沉积的FeCl3固体下方加热;
(4)为防止FeCl3潮解所采取的措施有②通入干燥的Cl2⑤用干燥的N2赶尽Cl2,
故选:②⑤;
(5)B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品,装置C的名称为干燥管;Fe[(CN)6]3-中CN-为配离子,则配离子的配位数是6;
故答案为:冷却,使FeCl3沉积,便于收集产品;干燥管;6;CN-;
(6)三价铁具有氧化性,硫化氢具有还原性,二者之间发生氧化还原反应:2FeCl3+3H2S=2FeCl2+6HCl+3S↓,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,
故答案为:2Fe3++H2S=2Fe2++S↓+2H+.
点评 本题考查了制备无水FeCl3实验操作和实验设计,题目难度中等,侧重考查铁、氯、硫及其化合物的性质应用、实验基本操作的分析判断、实验现象的推断和应用,试题综合性较强,有利于培养学生灵活应用基础知识的能力.

| A. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| B. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 盐酸与氢氧化钠溶液反应:H++OH-═H2O | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
| Fe3O4 | Fe2O3 | Fe | |
| 分解温度/°C | 1538 | 1400 | - |
| 熔点/°C | - | - | 1535 |
方案1:取该黑色物质溶于足量的稀硫酸中,观察是否有大量气体生成.
方案2:称取碾碎成粉末状的黑色物质a g,在空气中充分灼烧,待反应完全后,在干燥器里冷却,再称重,反复多次直到固体恒重,称得质量为b g,比较a、b的关系.
方案3:取少量碾碎成粉末状的黑色物质,用磁铁吸引,看是否被吸起.
你认为能够证明李强猜想的合理实验方案是方案2,其他方案不合理的原因是黑色固体中Fe含量很少,同时在溶液中发生反应:2Fe3++Fe=3Fe2+,则方案1看不到明显现象(只说其中的一个理由).
(2)针对李强的质疑,研究性学习小组又设计了新的探究方案,装置如下图所示.
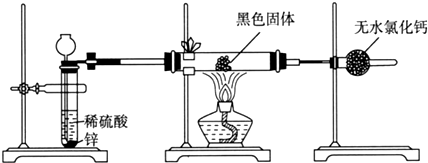
a.若反应都进行完全,要想确定黑色固体成分必须测定下列物理量中的②③⑤(只填序号).
①通入氢气体积V ②反应前,黑色固体+硬质玻璃管的总质量m1 ③完全反应后黑色固体+硬质玻璃管的总质量m2 ④实验前,干燥管质量m3 ⑤硬质玻璃管质量m4 ⑥锌粒质量m5 ⑦稀硫酸中含溶质的量n ⑧实验后,干燥管质量m6.
b.根据测定的实验数据,计算出黑色固体中Fe3O4的质量分数为$\frac{29(m1-m2)}{8(m2-m3)}$.
(3)向一定量FeO、Fe和Fe3O4的混合物中加入100 mL l.5 mol•L-1的盐酸,使混合物完全溶解,放出224mL(标准状况)气体,再向反应后的溶液中加入1 mol•L-1NaOH溶液,要使铁元素完全沉淀下来,所加入NaOH溶液的体积最少为C
A.90 mL B.100 mL C.150 mL D.200 mL.
①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3.
下列各微粒氧化能力由强到弱的顺序正确的是( )
| A. | Cl2>Fe2+>I2 | B. | Cl2>I2>Fe3+ | C. | Cl2>Fe3+>I2 | D. | Fe2+>Cl2>I2 |
 FeCl3•6H2O晶体
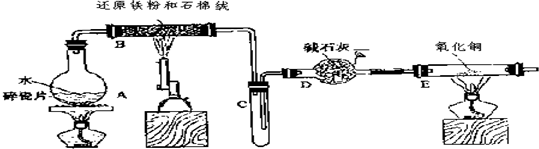
FeCl3•6H2O晶体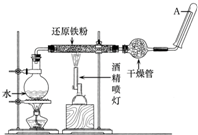 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.