题目内容
14.李强在学习了高中化学《铁及其化合物》一节的知识后,对初中“铁丝在氧气中燃烧”实验中的产物产生了疑惑,他认为燃烧时溅落下来的黑色物质中除了Fe3O4外可能还含有其他物质,为了验证自己的猜想,他在实验室中重做该实验,并进行了如下探究活动:查阅资料:①自然界中铁的氧化物主要是Fe3O4和Fe2O3两种,FeO高温时极易被氧化为Fe2O3,而Fe2O3在高温时又容易分解成Fe3O4和一种气体;②铁的氧化物的分解温度及铁的熔点:| Fe3O4 | Fe2O3 | Fe | |
| 分解温度/°C | 1538 | 1400 | - |
| 熔点/°C | - | - | 1535 |
方案1:取该黑色物质溶于足量的稀硫酸中,观察是否有大量气体生成.
方案2:称取碾碎成粉末状的黑色物质a g,在空气中充分灼烧,待反应完全后,在干燥器里冷却,再称重,反复多次直到固体恒重,称得质量为b g,比较a、b的关系.
方案3:取少量碾碎成粉末状的黑色物质,用磁铁吸引,看是否被吸起.
你认为能够证明李强猜想的合理实验方案是方案2,其他方案不合理的原因是黑色固体中Fe含量很少,同时在溶液中发生反应:2Fe3++Fe=3Fe2+,则方案1看不到明显现象(只说其中的一个理由).
(2)针对李强的质疑,研究性学习小组又设计了新的探究方案,装置如下图所示.
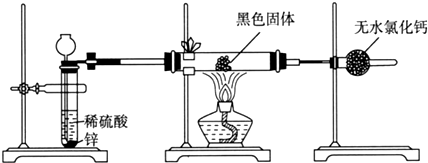
a.若反应都进行完全,要想确定黑色固体成分必须测定下列物理量中的②③⑤(只填序号).
①通入氢气体积V ②反应前,黑色固体+硬质玻璃管的总质量m1 ③完全反应后黑色固体+硬质玻璃管的总质量m2 ④实验前,干燥管质量m3 ⑤硬质玻璃管质量m4 ⑥锌粒质量m5 ⑦稀硫酸中含溶质的量n ⑧实验后,干燥管质量m6.
b.根据测定的实验数据,计算出黑色固体中Fe3O4的质量分数为$\frac{29(m1-m2)}{8(m2-m3)}$.
(3)向一定量FeO、Fe和Fe3O4的混合物中加入100 mL l.5 mol•L-1的盐酸,使混合物完全溶解,放出224mL(标准状况)气体,再向反应后的溶液中加入1 mol•L-1NaOH溶液,要使铁元素完全沉淀下来,所加入NaOH溶液的体积最少为C
A.90 mL B.100 mL C.150 mL D.200 mL.
分析 (1)根据Fe的熔点及两种氧化物的分解温度确定黑色物质的成分;
(2)根据反应前后黑色固体与硬质玻璃管总质量的差值即为Fe与O2反应消耗O2的质量来判断;
(3)当铁元素恰好完全沉淀时,溶液中剩余的溶质为NaCl,据此化学式可知n(Na+)=n(Cl-)=n(NaOH)=n(HCl),据此计算.
解答 解:(1)根据Fe的熔点及两种氧化物的分解温度可知Fe熔化的温度下,Fe2O3已分解,不可能存在于黑色物质中.验证黑色物质中是否存在Fe应利用Fe与Fe3O4的不同,酸液中,Fe3O4会生成Fe3+,将可能存在的Fe氧化为Fe2+,不放出气体,而Fe与Fe3O4 都有磁性,都能被磁铁吸引,Fe3O4也具有磁性,能被磁铁吸引,方案3不可取.故答案为:Fe和Fe3O4;黑色固体中Fe含量很少,同时在溶液中发生反应:2Fe3++Fe=3Fe2+,则方案1看不到明显现象;
(2)反应前后黑色固体与硬质玻璃管总质量的差值即为Fe与O2反应消耗O2的质量,为:m1-m2,根据反,3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4,从而可以求出原黑色固体中Fe3O4的质量是$\frac{29(m1-m2)}{8}$g,质量分数是$\frac{29(m1-m2)}{8(m2-m3)}$×100%=,故答案为:②③⑤;$\frac{29(m1-m2)}{8(m2-m3)}$;
(3)当铁元素恰好完全沉淀时,溶液中剩余的溶质为NaCl,据此化学式可知n(Na+)=n(Cl-)=n(NaOH)=n(HCl),即0.1 L×1.5 mol/L=1 mol/L×V(NaOH),解得:V(NaOH)=0.15 L.故选C.
点评 本题是一道关于铁元素以及化合物性质实验方案设计的考查题,注意知识的归纳和梳理是关键,难度不大.

| A. | CuSO4 | B. | NaOH | C. | H2SO4 | D. | HC1 |
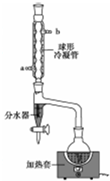 乙酸正丁酯是一种水果香味的无色透明液体,常用于调制香料和药物.实验室用正丁醇和乙酸制备,反应原理如下:
乙酸正丁酯是一种水果香味的无色透明液体,常用于调制香料和药物.实验室用正丁醇和乙酸制备,反应原理如下:CH3COOH+CH3CH2CH2CH2OH?△浓H2SO4CH3COOCH2CH2CH2CH3+H2O
某兴趣小组拟用如图装置制备少量乙酸正丁酯:
步骤1:加料.向干燥的100ml圆底烧瓶中加入37ml正丁醇、22ml冰醋酸及10滴浓硫酸(试剂加入顺序未确定),摇匀后,加入几粒沸石.然后安装分水器(先在分水器上端小心加水至分水器支管口处,然后再放出1~2ml的水)及回流冷凝管.
步骤2:加热回流.通过活塞控制分水器中水层液面的高度.反应完毕,停止加热.
步骤3:冷却(不可以拆卸回流冷凝管).冷却至室温后,将烧瓶中的混合物与分水器中的酯层合并,转入分液漏斗中.
步骤4:依次用10ml水,10ml 10%碳酸钠溶液洗至中性(pH=7),再水洗一次,向洗涤后的有机相中加入适量的无水硫酸镁固体.放置一段时间后过滤、蒸馏、收集124~126℃馏分,得产品)
步骤5:用一干燥的小烧杯称产品,重量为29.0g.
相关物质的性质如表:
| 物质名称 | 沸点/℃ | 熔点/℃ | 密度/g•cm-3 | 水中溶解度 |
| 正丁醇 | 117.3 | -89.5 | 0.80 | 7.1g/100g |
| 乙酸 | 118 | 16.6 | 1.0492 | 互溶 |
| 乙酸正丁酯 | 126.1 | -78 | 0.8826 | 1.4g/100g |
(1)加料时,三种试剂的加入顺序为正丁醇、冰醋酸、浓硫酸.
(2)该实验中,冷凝水从a(填“a”或“b”)口通入,使用分水器的目的是及时分离出产物水,使化学平衡向生成酯的方向移动,提高酯的产率.
(3)步骤2中判断反应结束的现象是分离器中水层高度不再变化.
(4)步骤3中从分液漏斗中得到酯的操作打开分液漏斗活塞,让水层从分液漏斗下口流出,酯层从上口倒出,用10% Na2CO3溶液洗涤有机相,是为了除去有机相中的H2SO4和CH3COOH(填结构简式).
(5)步骤4中加入无水硫酸镁固体的作用是除去有机相中残留的水.
(6)实验中正丁醇的转化率为65%.

 .
.
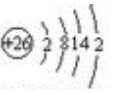 .FeCl3是共价化合物(填“离子”或“共价”).
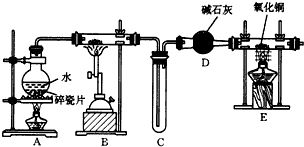
.FeCl3是共价化合物(填“离子”或“共价”). 图是实验室制乙酸乙酯的装置.
图是实验室制乙酸乙酯的装置. 实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.
实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.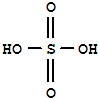 )溶于乙醇中并不是简单的物理溶解而是伴随着化学反应,生成了硫酸乙酯(
)溶于乙醇中并不是简单的物理溶解而是伴随着化学反应,生成了硫酸乙酯( )和硫酸二乙酯(
)和硫酸二乙酯(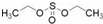 ).
).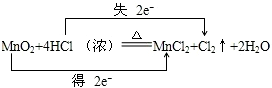 ;
;