题目内容
19.已知有如下反应:①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3.
下列各微粒氧化能力由强到弱的顺序正确的是( )
| A. | Cl2>Fe2+>I2 | B. | Cl2>I2>Fe3+ | C. | Cl2>Fe3+>I2 | D. | Fe2+>Cl2>I2 |
分析 氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,据此分析.
解答 解:①中Fe3+是氧化剂,I2是氧化产物,所以氧化性:Fe3+>I2,
②中Cl2是氧化剂,Fe3+是氧化产物,所以氧化性:Cl2>Fe3+,
综上得氧化性顺序为Cl2>Fe3+>I2.
故选C.
点评 本题考查氧化性强弱的判断规律:氧化剂的氧化性强于氧化产物的氧化性,可以根据所学知识进行回答,难度不大,关键正确判断氧化剂、还原剂.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.某学生的实验报告所列出的下列数据中合理的是( )
| A. | 用10 mL量筒量取7.13 mL盐酸 | |
| B. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| C. | 用25ml酸式滴定管量取21.70 mLKMnO4溶液 | |
| D. | 用托盘天平称量25.20 g NaCl |
11.一定条件下在2L的密闭容器中,充入2mol SO2和1molO2发生反应:
2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•moL-1,当气体的总物质的量减少0.8mol时反应达到平衡,下列有关叙述不正确的是( )
2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•moL-1,当气体的总物质的量减少0.8mol时反应达到平衡,下列有关叙述不正确的是( )
| A. | 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,V(正)>V(逆) | |
| B. | 相同温度下,起始时向容器中充入2mol SO3,达平衡时SO3的转化率为20% | |
| C. | 平衡混合气体中SO2的物质的量为1.2mol | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收39.2kJ的热量 |
9.室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A. | 溶液中导电粒子的数目减少 | |
| B. | 再加入10mL pH=11的NaOH溶液,混合液pH=7 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)c(O{H^-})}}$不变 |
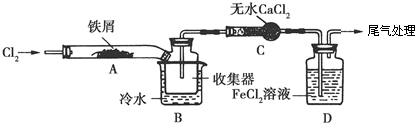
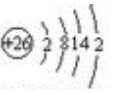 .FeCl3是共价化合物(填“离子”或“共价”).
.FeCl3是共价化合物(填“离子”或“共价”).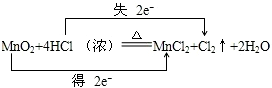 ;
;