��Ŀ����
1�����⻯�ƣ�NaAlH4�����л��ϳɵ���Ҫ��ԭ������ϳ���·ͼ��ʾ��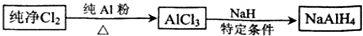
��1�����⻯����ˮ�������ҷ�Ӧ���䷴Ӧ�Ļ�ѧ����ʽΪNaAlH4+2H2O=NaAlO2+4H2����
��2��AlCl3��NaH��Ӧʱ���轫AlCl3�����л��ܼ����ٽ��õ�����Һ�μӵ�NaH��ĩ�ϣ��˷�Ӧ��NaH��ת���ʽϵ͵�ԭ���Ƿ�Ӧ���ɵ��Ȼ��Ƴ������⻯�Ʊ��棬��ֹ���Ȼ������⻯�ƽ�һ����Ӧ��
��3��ʵ��������1ͼװ����ȡ��ˮAlCl3��
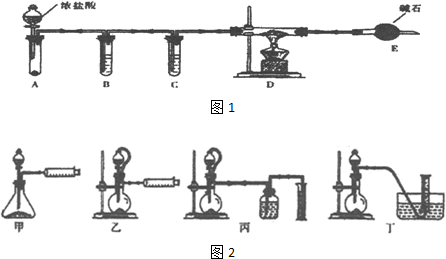
��A����ʢװ���Լ��Ǹ�����أ�����ػ��ظ���أ���
�ڵ�ȼD���ƾ���֮ǰ���ų�װ���еĿ�����������Ǵ�Һ©���Ļ���ʹA�з�����Ӧ����D�г�������ɫ������ʱ��ȼ�ƾ��ƣ�
��4���ı�A��D�е��Լ��Ϳ����ø�װ����ȡNaH����װ���в������������Ƶõ�NaH�п��ܺ��е�����ΪNa2O2
��5���������������װ�ã��ⶨ���⻯�ƴֲ�Ʒ��ֻ����NaH���ʣ��Ĵ��ȣ�
�Ӽ�Լ�ԡ�ȷ�Կ��ǣ������˵�װ����ͼ2���ң����ţ���
��ȡ15.6g��Ʒ��ˮ��ȫ��Ӧ��������ڱ�״���µ����Ϊ22.4L����Ʒ�����⻯�Ƶ���������Ϊ69%�������������λ��Ч���֣�
���� ��1�����⻯����ˮ�������ҷ�Ӧ����ƫ�����ƺ�������
��2��NaCl�����ӻ�������л���֮�以�����ܣ����Է�Ӧ���ɵ��Ȼ��Ƴ������⻯�Ʊ��棬��ֹ���Ȼ������⻯�ƽ�һ����Ӧ��
��3���Ȼ������Ʊ��ǽ�����������֮�䷴Ӧ�IJ��Ũ���������أ�����ػ��ظ���أ�֮���������ķ�Ӧ���������������ǽ������ױ��������������ʣ����Ե�ȼD���ƾ���֮ǰ���ų�װ���еĿ�����
��4�������ƺ�����֮�仯�Ͽ��Ե�NaH�����������е��Ȼ���Ҫ��ȥ�������ƺ����������»���������������ʣ�
��5���Ӽ�Լ�ԡ�ȷ�Կ��ǣ��ײ����������ʲ����ȣ������������к��д���������
NaAlH4+2H2O=NaAlO2+4H2��
NaH+H2O=NaOH+H2��
���ݹ�������������֮���ϵʽ�з���ʽ�������⻯������������
��� �⣺��1�����⻯����ˮ�������ҷ�Ӧ����ƫ�����ƺ��������䷴Ӧ�Ļ�ѧ����ʽΪNaAlH4+2H2O=NaAlO2+4H2�����ʴ�Ϊ��NaAlH4+2H2O=NaAlO2+4H2����
��2��AlCl3��NaH��Ӧʱ���轫AlCl3�����л��ܼ����ٽ��õ�����Һ�μӵ�NaH��ĩ�ϣ������ɵ�NaCl�����ӻ�������л���֮�以�����ܣ����Է�Ӧ���ɵ��Ȼ��Ƴ������⻯�Ʊ��棬��ֹ���Ȼ������⻯�ƽ�һ����Ӧ������NaH��ת���ʽϵͣ�
�ʴ�Ϊ����Ӧ���ɵ��Ȼ��Ƴ������⻯�Ʊ��棬��ֹ���Ȼ������⻯�ƽ�һ����Ӧ��
��3�����Ȼ������Ʊ��ǽ�����������֮�䷴Ӧ�IJ����װ��AΪ�Ʊ������ķ���װ�ã�Ũ���������أ�����ػ��ظ���أ�֮���������ķ�Ӧ����������������A����ʢװ���Լ�������Ϊ������أ�����ػ��ظ���أ���
�ʴ�Ϊ��������أ�����ػ��ظ���أ���
����Ϊ�������ױ��������������ʣ����Ե�ȼD���ƾ���֮ǰ���ų�װ���еĿ���������Һ©���Ļ���ʹA�з�����Ӧ����D�г�������ɫ������ʱ��ȼ�ƾ��ƣ�
�ʴ�Ϊ����Һ©���Ļ���ʹA�з�����Ӧ����D�г�������ɫ������ʱ��ȼ�ƾ��ƣ�
��4�������ƺ�����֮�仯�Ͽ��Ե�NaH�����������е��Ȼ���Ҫ��ȥ�������ƺ����������»���������������ʣ��ʴ�Ϊ��Na2O2��
��5���Ӽ�Լ�ԡ�ȷ�Կ��ǣ��ײ����������ʲ����ȣ������������к��д��������������⼸��װ�����ϴ�ѡ�ң�
NaAlH4+2H2O=NaAlO2+4H2��
NaH+H2O=NaOH+H2��
��n��NaAlH4��=xmol��n��NaH��=ymol��
$\left\{\begin{array}{l}{54x+24y=15.6}\\{4x+y=\frac{22.4}{22.4}}\end{array}\right.$
���$\left\{\begin{array}{l}{x=0.2}\\{y=0.2}\end{array}\right.$
m��NaAlH4��=0.2mol��54g/mol=10.8g��
��NaAlH4��������=$\frac{10.8g}{15.6g}��100%$=69%��
�ʴ�Ϊ���ң�69%��
���� ���⿼�������Ʊ���Ϊ��Ƶ���㣬�漰ʵ�������ʵ�����ۡ�����ʽ�ļ����֪ʶ�㣬��ȷʵ��ԭ����ʵ�������������������������֮��Ĺ�ϵʽ�ǽⱾ��ؼ������ؿ���ѧ������������֪ʶ�����Ӧ�ã�

 ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�ʵ��Ŀ�ģ�̽�������仯����������Ժͻ�ԭ�ԣ�ʵ�������Լ������ۡ�FeCl3��Һ��FeCl2��Һ����ˮ���⻯�ء�������Һ��ʵ���¼��
| ��� | ʵ������ | ʵ������ | ���ӷ���ʽ | ʵ����� |
| �� | ��FeCl2��Һ�е���������ˮ | ��Һ��dz��ɫ��Ϊ��ɫ | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+���л�ԭ�� |
| �� | ��FeCl3��Һ�м����������� | ��Һ�ɻ�ɫ��Ϊdz��ɫ | Fe+2Fe3+=3Fe2+ | Fe3+���������� |
| �� | ��FeCl3��Һ�е�������KI��Һ�͵�����Һ | ��Һ���ձ�Ϊ��ɫ | 2Fe3++2I-�T2Fe2++I2 | Fe3+���������� |
 ���ݱ��е���Ϣ�ж�����˵��������ǣ�������
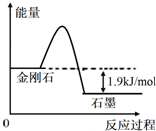
���ݱ��е���Ϣ�ж�����˵��������ǣ�������| ���� | �ܼ���/��kJ•mol-1�� | ȼ����/��kJ•mol-1�� |
| ���ʯ | a | 395.4 |
| ʯī | b | 393.5 |
| A�� | �ɱ�����Ϣ�ɵ�����ͼ��ʾ��ͼ�� | |
| B�� | �ɱ�����Ϣ֪C��ʯī��s��=C�����ʯ��s����H=+1.9kJ/mol | |
| C�� | �ɱ�����Ϣ����֪a��b | |
| D�� | ��ʾʯīȼ���ȵ��Ȼ�ѧ����ʽΪC��ʯī��s��+1/2O2��g���TCO��g����H=-393.5kJ/mol |
2SO2��g��+O2��g��?2SO3��g����H=-196kJ•moL-1��������������ʵ�������0.8molʱ��Ӧ�ﵽƽ�⣬�����й���������ȷ���ǣ�������
| A�� | �����¶Ȳ��䣬��ƽ�����������ٳ���1molSO2��0.5molO2ʱ��V��������V���棩 | |
| B�� | ��ͬ�¶��£���ʼʱ�������г���2mol SO3����ƽ��ʱSO3��ת����Ϊ20% | |
| C�� | ƽ����������SO2�����ʵ���Ϊ1.2mol | |
| D�� | ���������������䣬����ʼʱ�������г���2molSO3����ƽ��ʱ����39.2kJ������ |
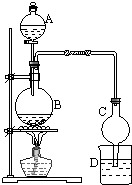 ��1��ij����С����Ƶ�ʵ������ȡ����������װ����ͼ��ʾ��A��ʢ��Ũ���ᣬB��ʢ���Ҵ������ᣬD��ʢ�б���̼������Һ��
��1��ij����С����Ƶ�ʵ������ȡ����������װ����ͼ��ʾ��A��ʢ��Ũ���ᣬB��ʢ���Ҵ������ᣬD��ʢ�б���̼������Һ��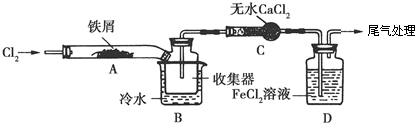
 ��FeCl3�ǹ��ۻ��������ӡ����ۡ�����
��FeCl3�ǹ��ۻ��������ӡ����ۡ����� ʵ�����Ʊ������������ǽ�3mL�Ҵ�����һ֧�Թ��У�Ȼ������Թܣ�����������2mLŨH2SO4��2mL���ᣬ����ͼ���Ӻ�װ�ã��ھƾ����ϼ��ȣ��۲�����
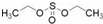
ʵ�����Ʊ������������ǽ�3mL�Ҵ�����һ֧�Թ��У�Ȼ������Թܣ�����������2mLŨH2SO4��2mL���ᣬ����ͼ���Ӻ�װ�ã��ھƾ����ϼ��ȣ��۲�����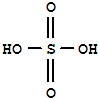 �������Ҵ��в����Ǽ������ܽ���ǰ����Ż�ѧ��Ӧ������������������
�������Ҵ��в����Ǽ������ܽ���ǰ����Ż�ѧ��Ӧ������������������ ���������������
��������������� ����
����