题目内容
12.计算题:(1)在标准状况下,将V L A气体(摩尔质量为M g•mol-1)溶于0.1L水中,所得溶液的密度为ρ g•cm-3,则此溶液的物质的量浓度(mol•L-1)为$\frac{1000Vρ}{(MV+2240)}$
(2)为预防碘缺乏病,常在食盐中添加少量的碘酸钾KIO3.碘酸钾和碘化钾在溶液中能发生下列反应:
5KI+KIO3+3H2SO 4═3I2+3K2SO4+3H2O
①该反应中,氧化剂是KIO3,还原剂是KI,氧化产物与还原产物的质量比5:1
②用双线桥表示出电子转移的方向和数目.
③当有1mol I2生成时,有$\frac{5}{3}$mol还原剂被氧化.
④当有1mol I2生成时,转移电子的数目为$\frac{5}{3}$NA.
分析 (1)结合n=$\frac{V}{Vm}$、c=$\frac{n}{V}$及溶液体积与密度的关系计算;
(2)5KI+KIO3+3H2SO 4═3I2+3K2SO4+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,以此来解答.
解答 解:(1)物质的量为$\frac{V}{22.4}$mol,溶液体积为$\frac{\frac{V}{22.4}×M+100}{ρ}$×10-3L,则c=$\frac{\frac{V}{22.4}}{\frac{\frac{V}{22.4}×M+100}{ρ}×1{0}^{-3}}$mol/L=$\frac{1000Vρ}{(MV+2240)}$mol/L,故答案为:$\frac{1000Vρ}{(MV+2240)}$;
(2)5KI+KIO3+3H2SO 4═3I2+3K2SO4+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,
①由化合价变化可知,氧化剂为KIO3,还原剂为KI,氧化产物与还原产物均为碘,其质量比为5:1,故答案为:KIO3;KI;5:1;
②氧化还原反应KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O中,化合价升高值=化合价降低值=转移电子数=5,电子转移情况如下: ,故答案为:
,故答案为: ;
;
③由反应可知,生成3mol碘时5molKI被氧化,则1mol I2生成时,有$\frac{5}{3}$mol还原剂被氧化,故答案为:$\frac{5}{3}$;
④由方程可知生成3mol碘转移5mol电子,有1mol I2生成时,转移电子的数目为$\frac{5}{3}$mol×NA=$\frac{5}{3}$NA,故答案为:$\frac{5}{3}$NA.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化及物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

| A. | 5.68g | B. | 7.1g | C. | 3.55g | D. | 1.42g |
| A. | 液态氢氧化钾 | B. | 液态氯化氢 | C. | 氯化钠溶液 | D. | 碳棒 |
| A. | 5%蔗糖溶液 | B. | 75%乙醇溶液 | ||
| C. | 0.5mol/LNaCl溶液 | D. | 1mol/LNaCl溶液 |
| A. | 在pH<5的溶液中:NH4+、K+、CH3COO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 在酸性且为无色透明的溶液中:K+、Ba2+、Fe2+、Br- | |
| D. | 在滴加石蕊变蓝的溶液中:Na+、S2-、CO32-、K+ |
| A. | 65:(A-65) | B. | 64:(A-65) | C. | 65:(A-64) | D. | 64:(A-64) |
| A. | 量筒 | B. | 玻璃棒 | C. | 三角漏斗 | D. | 容量瓶 |
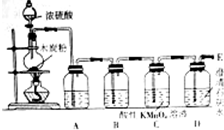 在100mL 18.4mol•L-1浓硫酸中加入1.2g木炭粉,加热使之充分反应.并按如图的装置图进行实验,依次检验反应得到的产物,请回答下列问题:
在100mL 18.4mol•L-1浓硫酸中加入1.2g木炭粉,加热使之充分反应.并按如图的装置图进行实验,依次检验反应得到的产物,请回答下列问题: