题目内容
7.下列各组离子在给定条件下能大量共存的是( )| A. | 在pH<5的溶液中:NH4+、K+、CH3COO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 在酸性且为无色透明的溶液中:K+、Ba2+、Fe2+、Br- | |
| D. | 在滴加石蕊变蓝的溶液中:Na+、S2-、CO32-、K+ |
分析 A.pH<5的溶液,显酸性;
B.离子之间结合生成沉淀;
C.Fe2+为浅绿色;
D.滴加石蕊变蓝的溶液,显碱性.
解答 解:A.pH<5的溶液,显酸性,不能大量存在CH3COO-,故A错误;
B.Ba2+、SO42-结合生成沉淀,不能大量共存,故B错误;
C.Fe2+为浅绿色,与无色不符,故C错误;
D.滴加石蕊变蓝的溶液,显碱性,该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
17.如图实验操作正确的是( )
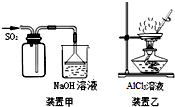

| A. | 用装置甲收集SO2 | |
| B. | 用装置乙制备AlCl3晶体 | |
| C. | 中和滴定时,锥形瓶用待装液润洗 | |
| D. | 使用分液漏斗和容量瓶时,先要检查是否漏液 |
18.将KCl和KBr的混合物13.4g溶于水配成500mL溶液,通入过量的Cl2,反应后将溶液蒸干,得到固体11.175g,则原来所配溶液中K+、Cl-、Br-的物质的量浓度之比为( )
| A. | 1:2:3 | B. | 1:3:2 | C. | 2:3:1 | D. | 3:2:1 |
15.设NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 0.1 L 3mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3NA | |
| B. | 1mol金刚石中含有的共价键数目为4NA | |
| C. | 1molNa2O2与足量的水反应,转移的电子数为2NA | |
| D. | 分子数为NA的CO、N2的混合气体在标准状况时体积约为22.4L,质量为28g |
2.下列玻璃仪器中,能用于加热的有( )
| A. | 烧杯 | B. | 容量瓶 | C. | 量筒 | D. | 试剂瓶 |
9.在0.1mol•L-1 Na2CO3溶液中,欲使CO32-的浓度尽量接近0.1mol•L-1,则应向溶液中加( )
| A. | HCl | B. | Na2CO3 | C. | NaCl | D. | KOH |

 .
.