题目内容
20.分别进行下列溶液的导电性实验,灯泡最亮的是( )| A. | 5%蔗糖溶液 | B. | 75%乙醇溶液 | ||
| C. | 0.5mol/LNaCl溶液 | D. | 1mol/LNaCl溶液 |
分析 电解质溶液导电性强弱与离子浓度成正比,与电荷成正比,分别进行下列溶液的导电性实验灯泡最亮,说明该溶液中离子浓度最大,据此分析解答.
解答 解:电解质溶液导电性强弱与离子浓度成正比,与电荷成正比,分别进行下列溶液的导电性实验灯泡最亮,说明该溶液中离子浓度最大,蔗糖和乙醇都是非电解质,在水溶液中以分子存在,两种溶液中离子浓度很小;
NaCl是强电解质,在水溶液中完全电离,0.5mol/LNaCl溶液离子浓度小于1mol/LNaCl溶液,所以离子浓度最大的是D,则溶液导电性最强的是D,故选D.
点评 本题考查电解质溶液导电性强弱判断,为高频考点,明确电解质溶液导电性影响因素是解本题关键,知道常见电解质、非电解质,题目难度不大.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目
8.下列大小关系正确的是( )
| A. | 熔点:HI<HBr | B. | 硬度:MgO>CaO | ||
| C. | 晶格能:NaCl<NaBr | D. | 熔沸点:CO2>NaCl |
15.设NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 0.1 L 3mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3NA | |
| B. | 1mol金刚石中含有的共价键数目为4NA | |
| C. | 1molNa2O2与足量的水反应,转移的电子数为2NA | |
| D. | 分子数为NA的CO、N2的混合气体在标准状况时体积约为22.4L,质量为28g |
2.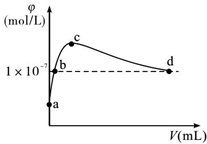 常温下,将CO2通入2LpH=12的KOH溶液中.溶液中水电离出的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如图所示.下列叙述不正确的是( )
常温下,将CO2通入2LpH=12的KOH溶液中.溶液中水电离出的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如图所示.下列叙述不正确的是( )
 常温下,将CO2通入2LpH=12的KOH溶液中.溶液中水电离出的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如图所示.下列叙述不正确的是( )
常温下,将CO2通入2LpH=12的KOH溶液中.溶液中水电离出的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-12mol/L | |
| B. | b点溶液中:c(H+)=1×10-7mol/L | |
| C. | c点溶液中:c(K+)=2[c(CO${\;}_{3}^{2-}$)+c(HCO3-)+c(H2CO3)] | |
| D. | d点溶液中:c(K+)=2c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$) |
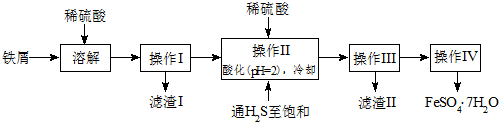

 $\stackrel{Br_{2}/P}{→}$
$\stackrel{Br_{2}/P}{→}$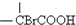
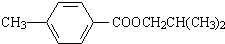 .
.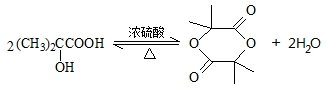 ,该反应属于酯化反应(填反应类型).
,该反应属于酯化反应(填反应类型).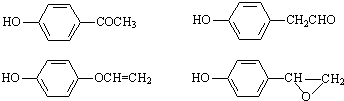 .
. )结构.
)结构.