题目内容
17.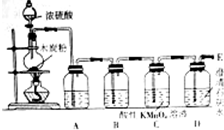 在100mL 18.4mol•L-1浓硫酸中加入1.2g木炭粉,加热使之充分反应.并按如图的装置图进行实验,依次检验反应得到的产物,请回答下列问题:
在100mL 18.4mol•L-1浓硫酸中加入1.2g木炭粉,加热使之充分反应.并按如图的装置图进行实验,依次检验反应得到的产物,请回答下列问题:(1)为了除去水蒸气,则在集气瓶A中装一种液体试剂,则该试剂是c.
a.氢氧化钠溶液 b.浓硝酸 c.浓硫酸 d.饱和食盐水
(2)为了检验浓硫酸与木炭粉反应生成的二氧化硫,在B瓶中装的试剂是品红溶液(填化学式或名称),C瓶中KMnO4溶液的作用是氧化除去混合气体中的SO2,并检验SO2是否除尽.
(3)已知二氧化硫可以与过氧化钠反应生成硫酸钠,如果将C瓶中装的KMnO4溶液用足量的过氧化钠固体代替,则D瓶中澄清石灰水不变(填”变“或”不变“)浑浊,从导管E处出来的气体主要含有氧气(填化学式或名称)和水蒸气.
(4)假定上述条件下浓硫酸与木炭粉发生反应,最终木炭粉完全消失,冷却到室温,忽略溶液体积的变化,则烧瓶中溶质的物质的量浓度是多少?
分析 (1)被干燥的气体不能反应,浓硫酸具有吸水性,可以干燥二氧化碳与二氧化硫;
(2)一般用品红溶液检验SO2,用澄清石灰水检验CO2,因SO2和CO2都能使石灰水变浑浊,要先用品红溶液检验SO2,然后除掉SO2,再检验CO2;
(3)二氧化硫与过氧化钠反应生成硫酸钠,二氧化碳与过氧化钠反应生成碳酸钠与氧气;
(4)根据C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$2S02↑+C02↑+2H2O计算参加反应硫酸物质的量,进而计算烧瓶中硫酸的物质的量浓度.
解答 解:(1)氢氧化钠溶液可以吸收二氧化硫与二氧化碳,浓硝酸没有吸水性,具有挥发性,可以氧化二氧化硫,饱和食盐水不能吸收水蒸气,浓硫酸具有吸水性,不与二氧化碳、二氧化硫反应,可以干燥二氧化碳与二氧化硫,
故选:c;
(2)B装置中盛放品红溶液,品红溶液红色褪去,说明生成SO2,C装置中酸性高锰酸钾溶液氧化除去混合气体中的SO2,酸性高锰酸钾溶液紫红色没有完全褪去,说明SO2除尽,D中澄清石灰水变浑浊,说明生成CO2,
故答案为:品红溶液;氧化除去混合气体中的SO2,并检验SO2是否除尽;
(3)二氧化硫与过氧化钠反应生成硫酸钠,二氧化碳与过氧化钠反应生成碳酸钠与氧气,从C装置中导出的气体为氧气,D瓶中澄清石灰水不变浑浊,从导管E处出来的气体主要含有氧气和水蒸气,
故答案为:不变;氧气;
(4)1.2g碳的物质的量为$\frac{1.2g}{12g/mol}$=0.1mol,由C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$2S02↑+C02↑+2H2O,可知参加反应硫酸物质的量为0.1mol×2=0.2mol,烧瓶中硫酸的物质的量浓度为$\frac{0.1L×18.4mol/L-0.2mol}{0.1L}$=16.4mol/L,
答:烧瓶中硫酸的物质的量浓度为16.4mol/L.
点评 本题考查浓硫酸性质、化学实验、化学计算等,关键是明确实验原理,理解各装置的作用,难度中等.

| A. | 加水稀释成100 mL | B. | 加入10 mL的水进行稀释 | ||
| C. | 加入10 mL 0.01 mol/L的NaOH溶液 | D. | 加入10 mL 0.01 mol/L的HCl溶液 |
| A. | 熔点:HI<HBr | B. | 硬度:MgO>CaO | ||
| C. | 晶格能:NaCl<NaBr | D. | 熔沸点:CO2>NaCl |
| A. | C2H6 | B. | C2H4 | C. | C3H6 | D. | C6H10 |
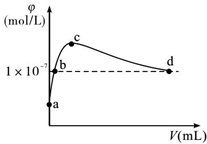 常温下,将CO2通入2LpH=12的KOH溶液中.溶液中水电离出的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如图所示.下列叙述不正确的是( )
常温下,将CO2通入2LpH=12的KOH溶液中.溶液中水电离出的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-12mol/L | |
| B. | b点溶液中:c(H+)=1×10-7mol/L | |
| C. | c点溶液中:c(K+)=2[c(CO${\;}_{3}^{2-}$)+c(HCO3-)+c(H2CO3)] | |
| D. | d点溶液中:c(K+)=2c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$) |
| A. | NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28′ | |
| C. | NaCl晶体中与每个Na+距离相等且最近的Na+共有8个 | |
| D. | 区分晶体和非晶体最科学的方法是对固体进行X一射线衍射实验 |