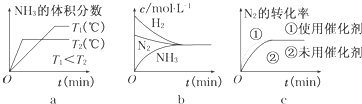
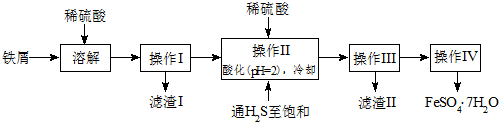
题目内容
2.某温度下,一定量Cl2和100mL2mol/L氢氧化钠溶液恰好完全反应,生成的NaClO、NaClO3物质的量之比为1:3,则被还原的氯元素的质量为( )| A. | 5.68g | B. | 7.1g | C. | 3.55g | D. | 1.42g |
分析 一定量Cl2和100mL2mol/L氢氧化钠溶液恰好完全反应,由生成物为氯化钠、次氯酸钠和氯酸钠,由组成可知,n(Cl2)=$\frac{1}{2}$n(NaOH)可以根据反应物和生成物来书写方程式,从反应中找到被还原的氯元素即化合价降低的氯元素,被氧化的氯元素即化合价升高的氯元素,或者根据电子守恒来确定.
解答 解:根据ClO-与ClO3-的浓度之比1:3,由Cl到ClO-,失去1个电子,由Cl到ClO3-,失去5个电子,一共失去1+3×5=16个电子;由Cl到Cl-,得到1个电子,需要16个原子才能得到16个电子,所以,被还原的氯元素与被氧化的氯元素的物质的量之比=16:(1+3)=4:1,n(Cl2)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.2mol=0.1mol,所以被还原的氯元素的质量为0.1mol×$\frac{4}{5}$×71g/mol=5.68g,故选:A.
点评 本题考查学生氧化还原反应的有关知识,注意电子守恒思想在解题中的运用.

练习册系列答案
相关题目
13.下列各组离子中,一定能够大量共存的是( )
| A. | Na+、Al3+、Cl-、CO32- | B. | Fe2+、H+、SO42-、NO3- | ||
| C. | K+、Fe3+、NO3-、SCN- | D. | Mg2+、NH4+、Cl-、SO42- |
17.如图实验操作正确的是( )


| A. | 用装置甲收集SO2 | |
| B. | 用装置乙制备AlCl3晶体 | |
| C. | 中和滴定时,锥形瓶用待装液润洗 | |
| D. | 使用分液漏斗和容量瓶时,先要检查是否漏液 |
7.现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )
| A. | 加水稀释成100 mL | B. | 加入10 mL的水进行稀释 | ||
| C. | 加入10 mL 0.01 mol/L的NaOH溶液 | D. | 加入10 mL 0.01 mol/L的HCl溶液 |

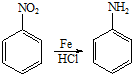
 +2NaOH$→_{一定条件}^{水}$
+2NaOH$→_{一定条件}^{水}$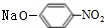 +NaCl+H2O.
+NaCl+H2O.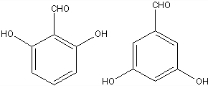 、
、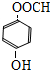 .
.