题目内容
11.写出下列物质的电离方程式.(1)CaCl2:CaCl2═Ca2++2Cl-
(2)Ba(OH)2:Ba(OH)2═Ba2++2OH-
(3)KHSO4:KHSO4═K++H++SO42-
(4)KHCO3:KHCO3═K++HCO3-.
分析 分清电解质强弱,强电解质在水溶液中完全电离,在书写电离方程式时用符号“=”,弱电解质,部分电离,在书写电离方程式时用符号“?”,多元弱酸分步电离,据此解答.
解答 解:(1)CaCl2为盐属于强电解质,完全电离,电离方程式:CaCl2═Ca2++2Cl-;
故答案为:CaCl2═Ca2++2Cl-;
(2)Ba(OH)2是强碱,属于强电解质,完全电离,电离方程式:Ba(OH)2═Ba2++2OH-;
故答案为:Ba(OH)2═Ba2++2OH-;
(3)KHSO4是强酸的酸式盐,属于强电解质,完全电离,电离方程式:KHSO4═K++H++SO42-;
故答案为:KHSO4═K++H++SO42-;
(4)KHCO3是弱酸的酸式盐,属于强电解质,完全电离出钠离子与碳酸氢根离子,电离方程式:KHCO3═K++HCO3-;
故答案为:KHCO3═K++HCO3-.
点评 本题考查了电解质电离方程式书写,明确电解质强弱及电离方式是解题关键,注意多元弱酸的酸式根离子不能拆,题目难度不大.

练习册系列答案
相关题目
11.某硝酸盐受热分解生成金属氧化物、二氧化氮和氧气,若生成的二氧化氮和氧气的物质的量之比为8:1,则金属元素的化合价在反应过程中的变化是( )
| A. | 升高 | B. | 降 低 | C. | 不变 | D. | 无法确定 |
12.表是某食品包装袋上的说明,从表中的配料中分别选出一种物质填在相应的横线上.
其中属于着色剂的有柠檬黄、日落黄,属于调味剂的有柠檬酸、甜蜜素、菠萝香精、蔗糖,属于防腐剂的有山梨酸钾,属于营养素的有浓缩菠萝汁、维生素C.
| 品名 | 浓缩菠萝汁 |
| 配料 | 水、浓缩菠萝汁、蔗糖、柠檬酸、甜蜜素、维生素C、菠萝香精、柠檬黄、日落黄、山梨酸钾等. |
9.下列实验过程中产生的现象与右边座标图形相符合的是( )


| A. | 稀盐酸中加一定量CaCO3(横坐标是碳酸钙的质量,纵坐标为气体体积) | |
| B. | Ca(OH)2溶液中滴入溶液(横坐标是Na2CO3溶液的体积,纵坐标为沉淀质量) | |
| C. | 稀盐酸滴加到AgNO3溶液中(横坐标是稀盐酸的体积,纵坐标为溶液的导电能力) | |
| D. | 稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力) |
 .
.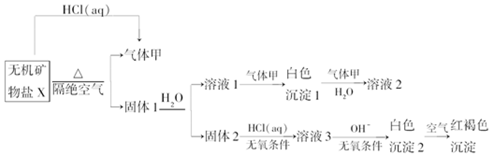
 ,写出气体甲的电子式
,写出气体甲的电子式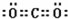 .
.