题目内容
20.镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是阳极Cu可以发生氧化反应生成Cu2+,补充溶液中消耗的Cu2+,保持溶液中Cu2+的浓度恒定.分析 用铜作电极可及时补充电镀液中消耗的Cu2+,保持其浓度恒定.
解答 解:电镀铜时用铜做阳极,阳极上铜被氧化,电解质溶液浓度不变,用铜作电极可及时补充电镀液中消耗的Cu2+,保持其浓度恒定,采用石墨无法补充Cu2+,
故答案为:阳极Cu可以发生氧化反应生成Cu2+,补充溶液中消耗的Cu2+,保持溶液中Cu2+的浓度恒定.
点评 本题主要考查电解池的原理,明确电镀装置图的原理是解题的关键,注意基础知识的积累.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
20.一定能使反应速率加快的因素是( )
①扩大容器的容积 ②使用催化剂 ③增加反应物的质量④升高温度 ⑤缩小容积.
①扩大容器的容积 ②使用催化剂 ③增加反应物的质量④升高温度 ⑤缩小容积.
| A. | ②③④⑤ | B. | ②③④ | C. | ②③ | D. | ④ |
8.某溶液中含有Ba2+、Ag+、Cu2+三种离子,现用①NaOH溶液;②K2SO4溶液;③HCl将这三种离子逐一沉淀并加以分离,则加入试剂顺序正确的是( )
| A. | ①②③ | B. | ③②① | C. | ②③① | D. | ①③② |
5.下列装置或操作能达到试验目的是( )
| A. |  实验室制取并收集NH3 | B. |  石油的蒸馏 | ||
| C. |  检查装置气密性 | D. |  利用排空气发收集CO2 |
12.用NA表示阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 2gH2中含有的分子数为NA | |
| B. | 1mol Zn变成Zn2+时失去的电子数为NA | |
| C. | 1L1mol•L-1MgCl2溶液中含有的Cl-数为NA | |
| D. | 常温常压下,22.4LO2含有的原子数为NA |
10.在有机化合物中,一个碳原子与其他原子不能同时形成的化学键是( )
| A. | 四个共价单键 | B. | 一个双键,一个三键 | ||
| C. | 两个单键,一个双键 | D. | 一个单键,一个三键 |
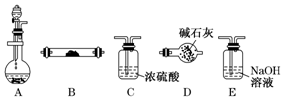 如图是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去).请根据下列要求回答问题.
如图是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去).请根据下列要求回答问题.