题目内容
1.某研究小组为了探究一种无机矿物盐X(仅含四种元素,且为复盐)的组成和性质,设计并完成了如下实验(注aq表示溶液):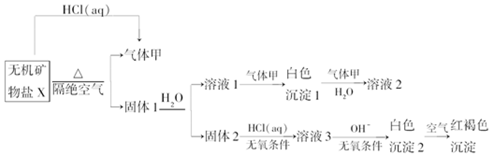
取10.80g X在惰性气流中加热至完全分解,得到6.40g固体1和0.1mol的气体甲.回答如下问题:
(1)画出白色沉淀1中正二价金属元素的离子结构示意图
 ,写出气体甲的电子式
,写出气体甲的电子式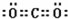 .
.(2)X的化学式是CaFe(CO3)2,在惰性气流中加热X至完全分解的化学方程式为CaFe(CO3)2$\frac{\underline{\;\;△\;\;}}{\;}$CaO+FeO+2CO2↑.
(3)白色沉淀2在空气中变成红褐色沉淀的原因是4Fe(OH)2+2H2O+O2=4Fe(OH)3(用化学方程式表示).
(4)一定条件下,气体甲与固体1中的FeO成分可能发生氧化还原反应.
分析 X能和HCl反应生成气体甲,隔绝空气加热X得到气体甲和固体1,且X和HCl(aq)反应也能得到甲,因此猜测X是碳酸盐,因为X加热易分解且能和酸反应生成CO2,那么甲为CO2,固体1溶于水得到溶液1和固体2,溶液1和二氧化碳反应生成白色沉淀1,白色沉淀1和二氧化碳、水反应生成溶液2,则白色沉淀1为碳酸盐、溶液2为碳酸氢盐;
固体2和稀盐酸反应生成溶液3,且需要无氧条件,溶液3中加入碱在无氧条件下生成白色沉淀2,白色沉淀2被空气氧化生成红褐色沉淀,则白色沉淀2是Fe(OH)2,溶液3为FeCl2,X仅含4种元素,碳酸盐分解生成二氧化碳气体和两种氧化物,其中一种氧化物能溶于水,结合地壳的成分猜测固体1中成分为CaO、FeO,对应地,X应为CaFe(CO3)2,结合题中信息:10.80g X在惰性气流中加热至完全分解,得到6.40g固体1,经计算,确认X为CaFe(CO3)2,那么,溶液1是Ca(OH)2,白色沉淀1是CaCO3,溶液2是Ca(HCO3)2,再结合题目分析解答.
解答 解:(1)根据以上分析,白色沉淀1是CaCO3,碳酸钙中金属元素的原子核外有4个电子层、最外层有2个电子,所以Ca原子结构示意图为 ,气体甲是二氧化碳,二氧化碳的电子式为
,气体甲是二氧化碳,二氧化碳的电子式为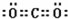 ,
,
故答案为: ;
;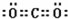 ;
;
(2)通过以上分析知,X的化学式是 CaFe(CO3)2,在惰性气流中加热X至完全分解生成二氧化碳和氧化钙、氧化亚铁,所以该反应的化学反应方程式为CaFe(CO3)2$\frac{\underline{\;\;△\;\;}}{\;}$CaO+FeO+2CO2↑,
故答案为:CaFe(CO3)2;CaFe(CO3)2$\frac{\underline{\;\;△\;\;}}{\;}$CaO+FeO+2CO2↑;
(3)氢氧化亚铁不稳定,易被空气氧化生成红褐色氢氧化铁,所以白色沉淀2在空气中变成红褐色沉淀,反应方程式为4Fe(OH)2+2H2O+O2=4Fe(OH)3,故答案为:4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,氧化亚铁具有还原性,能被二氧化碳氧化生成四氧化三铁或氧化铁,同时生成CO,反应方程式为2FeO+CO2$\frac{\underline{\;一定条件下\;}}{\;}$Fe2O3+CO(或生成Fe3O4),故答案为:FeO.
点评 本题考查了无机物推断,涉及物质结构、物质的性质、离子的检验等知识点,熟悉元素化合物的性质是解本题关键,知道流程图中每一步发生的反应及反应现象,题目难度中等.

| A. | 2gH2中含有的分子数为NA | |
| B. | 1mol Zn变成Zn2+时失去的电子数为NA | |
| C. | 1L1mol•L-1MgCl2溶液中含有的Cl-数为NA | |
| D. | 常温常压下,22.4LO2含有的原子数为NA |
| A. | 四个共价单键 | B. | 一个双键,一个三键 | ||
| C. | 两个单键,一个双键 | D. | 一个单键,一个三键 |
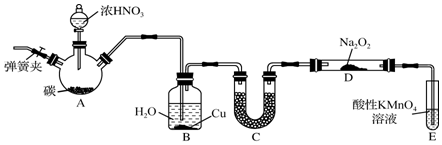
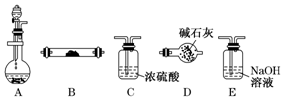 如图是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去).请根据下列要求回答问题.
如图是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去).请根据下列要求回答问题.