题目内容
11.某硝酸盐受热分解生成金属氧化物、二氧化氮和氧气,若生成的二氧化氮和氧气的物质的量之比为8:1,则金属元素的化合价在反应过程中的变化是( )| A. | 升高 | B. | 降 低 | C. | 不变 | D. | 无法确定 |
分析 某金属的硝酸盐受热分解生成NO2、O2和某金属氧化物,氮元素化合价由+5价降低为+4价,氧元素化合价由-2价升高为0价,根据NO2和 O2的物质的量之比为8:1,计算氮原子得到的电子、氧原子失去的电子.根据电子转移守恒,判断金属元素化合价变化.
解答 解:某金属的硝酸盐受热分解生成NO2、O2和某金属氧化物,氮元素化合价由+5价降低为+4价,氧元素化合价由-2价升高为0价,生成的二氧化氮和氧气的物质的量之比为8:1,令NO2和 O2的物质的量分别为8mol、1mol,氮原子得到的电子物质的量为8mol×(5-4)=8mol,氧原子失去的电子为1mol×2×[0-(-2)]=4mol.二者氮原子得到的电子大于氧原子失去的电子,根据电子转移守恒,金属原子应提供电子,所以金属元素化合价升高.
故选:A.
点评 考查氧化还原反应的计算,难度不大,根据电子转移守恒判断是关键.注意守恒思想的应用.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
2.下列叙述的方法不正确的是( )
| A. | 金属的电化学腐蚀比化学腐蚀更普遍 | |
| B. | 在铁板表面涂抹油漆,不能防止铁板被腐蚀 | |
| C. | 钢铁在干燥空气中不易被腐蚀 | |
| D. | 用牺牲锌块的方法来保护船身 |
20.一定能使反应速率加快的因素是( )
①扩大容器的容积 ②使用催化剂 ③增加反应物的质量④升高温度 ⑤缩小容积.
①扩大容器的容积 ②使用催化剂 ③增加反应物的质量④升高温度 ⑤缩小容积.
| A. | ②③④⑤ | B. | ②③④ | C. | ②③ | D. | ④ |
 其中氧化剂是MnO2,氧化产物是Cl2,氧化剂和还原剂物质的量之比是1:2.
其中氧化剂是MnO2,氧化产物是Cl2,氧化剂和还原剂物质的量之比是1:2.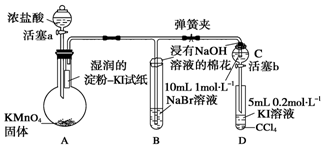
 ;A中发生的反应的化学反应方程式为2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O.
;A中发生的反应的化学反应方程式为2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O.