题目内容
11.25℃时,向a mL 2.0mol•L-1的NaOH溶液中加入2.0mol•L-1的醋酸溶液,当加入bmL醋酸溶液时,混合溶液的pH为7,假设混合溶液的体积为(a+b)mL,已知,醋酸的电离平衡常数1.75×10-5,则$\frac{a}{b}$的值为( )| A. | $\frac{175}{176}$ | B. | $\frac{100}{99}$ | C. | $\frac{99}{100}$ | D. | $\frac{1}{2}$ |
分析 25℃时,混合溶液pH=7,说明溶液呈中性,则溶液中c(H+)=c(OH-)=10-7 mol/L,根据电荷守恒得c(CH3COO-)=c(Na+)=$\frac{2a}{a+b}$mol/L,根据物料守恒得c(CH3COOH)=$\frac{2b-2a}{a+b}$mol/L,根据电离平衡常数计算$\frac{a}{b}$的值.
解答 解:25℃时,混合溶液pH=7,说明溶液呈中性,则溶液中c(H+)=c(OH-)=10-7 mol/L,根据电荷守恒得c(CH3COO-)=c(Na+)=$\frac{2a}{a+b}$mol/L,根据物料守恒得c(CH3COOH)=$\frac{2b-2a}{a+b}$mol/L,电离平衡常数=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{\frac{2a}{a+b}×1{0}^{-7}}{\frac{2(b-a)}{a+b}}$=1.75×10-5,则$\frac{a}{b}$=$\frac{175}{176}$,故选A.
点评 本题考查酸碱混合溶液定性判断及电离平衡常数有关计算,为高频考点,侧重考查学生分析计算能力,电离平衡常数只与温度有关,与溶液酸碱性无关,注意混合溶液中c(CH3COOH)的计算,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.在实验室进行教材中重点演示实验,括号内的实验仪器或试剂都能用到的是( )
| A. | 蔗糖的水解(试管、蔗糖溶液、新制的Cu(OH)2悬浊液) | |
| B. | 用NaOH标准溶液确定未知浓度的硫酸溶液(石蕊试液、碱式滴定管、锥形瓶) | |
| C. | 证明海带中存在碘元素(漏斗、稀硫酸、氯气、玻璃棒) | |
| D. | 制氢氧化铁胶体(饱和FeCl3溶液、NaOH溶液、胶头滴管) |
2. 想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.
想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.
(1)0.1000mol•L-1NaOH溶液中由水电离出的c(OH)-=1×10-13mol•L-1
(2)滴定时用酸式(填“酸式”或“碱式”)滴定管将待测液移入锥形瓶中.
(3)若滴定时选用的指示剂是酚酞,则终点的想象是滴入最后一滴NaOH标准液,溶液由无色变为粉红色,且半分钟内不褪色
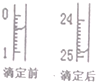
(4)中和滴定有关数据记录如下表,如图表示下表中第1次滴定时50mL滴定管中前后液面的位置
则表中z=24.50mL
(5)根据所给数据,盐酸溶液的物质的量浓度c=0.1020mol•L-1(保留四位有效数字)
(6)下列操作会使测定结果偏高的有ad
a.洗涤碱式滴定管时未用装溶液润洗
b.洗涤时锥形瓶只用蒸馏水洗净后而未润洗
c.读所用标准液体积时,滴定前仰视,滴定后仰视
d.滴定时标准液不小心滴入到锥形瓶外面.
 想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.
想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.(1)0.1000mol•L-1NaOH溶液中由水电离出的c(OH)-=1×10-13mol•L-1
(2)滴定时用酸式(填“酸式”或“碱式”)滴定管将待测液移入锥形瓶中.
(3)若滴定时选用的指示剂是酚酞,则终点的想象是滴入最后一滴NaOH标准液,溶液由无色变为粉红色,且半分钟内不褪色
(4)中和滴定有关数据记录如下表,如图表示下表中第1次滴定时50mL滴定管中前后液面的位置
| 滴定序号 | 待测液体积(mL) | 所消耗NaOH标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 25.00 | x | y | z |
| 2 | 25.00 | 4.00 | 29.60 | 25.60 |
| 3 | 25.00 | 0.60 | 26.00 | 25.40 |
(5)根据所给数据,盐酸溶液的物质的量浓度c=0.1020mol•L-1(保留四位有效数字)
(6)下列操作会使测定结果偏高的有ad
a.洗涤碱式滴定管时未用装溶液润洗
b.洗涤时锥形瓶只用蒸馏水洗净后而未润洗
c.读所用标准液体积时,滴定前仰视,滴定后仰视
d.滴定时标准液不小心滴入到锥形瓶外面.
19.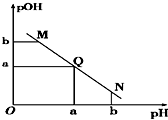 某温度下,向一定体积1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg c[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg c[OH-])与pH的变化关系如图所示,则( )
 某温度下,向一定体积1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg c[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg c[OH-])与pH的变化关系如图所示,则( )| A. | M点所示溶液导电能力强于Q点 | |
| B. | N点所示溶液中c(CH3COO-)>c(Na+) | |
| C. | M点和N点所示溶液中水的电离程度不相同 | |
| D. | Q点消耗NaOH溶液的体积小于醋酸溶液的体积 |
6.室温时,将浓度和体积分别为C1、V1的NaOH溶液和C2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是( )
| A. | 若pH>7时,则一定是C1V1>C2V2 | |
| B. | 若pH<7时,混合溶液中可能有c(Na+)>c(H+) | |
| C. | 当pH=7时,若V1=V2,则一定是C2=C1 | |
| D. | 若 V1=V2,C1=C2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
16.25°C时,pH=2的某酸HnA(An-为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为5.下列判断正确的是( )
| A. | 生成的正盐化学式为BmAn | |
| B. | 该盐中存在着一定水解的离子,该离子水解方程式为:Bm++mH2O?B(OH)m+mH+ | |
| C. | 生成的盐为强酸弱碱盐 | |
| D. | HnA为弱酸,其第一步电离方程式为:HmA?Hm-1A-+H+ |
3.下列叙述正确的是( )
| A. | 在中和热的测定实验中,应将碱液缓慢倒入酸液中,使反应充分进行 | |
| B. | 用NaOH标准溶液滴定醋酸溶液至中性时,醋酸则被完全中和 | |
| C. | 将Na2S2O3溶液和稀硫酸混合,可通过观察产生气泡的快慢来判断化学反应速率 | |
| D. | 将铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色沉淀 |
20.垃圾无害化处理有利于保护生态环境.下列有关生活垃圾的处理合理的是( )
| A. | 废旧塑料露天焚烧 | B. | 用厨房垃圾生产沼气 | ||
| C. | 废旧电池就地填埋 |
1.某元素原子的结构示意图为 ,关于该原子说法正确的是( )
,关于该原子说法正确的是( )
 ,关于该原子说法正确的是( )
,关于该原子说法正确的是( )| A. | 核电荷数为32 | B. | 核外电子数为6 | ||
| C. | 有3个电子层 | D. | 比其阴离子多2个电子 |