题目内容
19.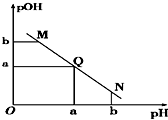 某温度下,向一定体积1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg c[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg c[OH-])与pH的变化关系如图所示,则( )| A. | M点所示溶液导电能力强于Q点 | |
| B. | N点所示溶液中c(CH3COO-)>c(Na+) | |
| C. | M点和N点所示溶液中水的电离程度不相同 | |
| D. | Q点消耗NaOH溶液的体积小于醋酸溶液的体积 |
分析 A.由于醋酸是弱酸,电离程度很小,Q点的pOH=pH,溶液为中性,醋酸溶液中离子浓度小于Q点溶液中离子浓度;
B.N点所示溶液为碱性,结合电荷守恒判断;
C.M点的溶液中氢氧根离子源于水的电离,N点氢氧根离子源于水的电离,结合M点氢离子浓度与N点氢氧根离子浓度判断;
D.Q点的pOH=pH,溶液为中性,而两者等体积混合后生成醋酸钠,水解显碱性,则醋酸稍过量些.
解答 解:A.Q点的pOH=pH,溶液为中性,由于醋酸是弱酸,电离程度很小,离子浓度也较小,醋酸溶液中离子浓度小于Q点溶液中离子浓度,故M点溶液的导电能力较弱,故A错误;
B.N点所示溶液为碱性,则c(H+)<c(OH-),由电荷守恒:c(H+)+c(Na+)=c(CH3COO-)+c(OH-),可得:c(Na+)>c(CH3COO-),故B错误;
C.M点的溶液中氢氧根离子源于水的电离,N点氢氧根离子源于水的电离,由于M点的H+浓度等于N点的OH-浓度,所以两点水电离程度相同,故C错误;
D.Q点的pOH=pH,溶液为中性,而两者等体积混合后生成醋酸钠,水解显碱性,则醋酸稍过量些,所加NaOH溶液体积略小于醋酸溶液的体积,故D正确.
故选D.
点评 本题考查酸碱混合的定性判断、离子浓度比较等,侧重于弱电解质的电离的考查,注意弱电解质的电离特点,把握pOH的含义,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,c是否一定等于0.2否(选填“是”或“否”).
(2)单从乙组实验结果分析,HA是弱酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(3)丙组实验所得混合溶液中下列算式的精确结果:c(OH-)-c(HA)=10-9mol/L.
| 实验编号 | HA物质的量浓度/(mol•L-1) | NaOH物质的量浓度/(mol•L-1) | 混合溶液的pH |
| 甲 | c | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH>7 |
| 丙 | 0.1 | 0.1 | pH=9 |
(2)单从乙组实验结果分析,HA是弱酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(3)丙组实验所得混合溶液中下列算式的精确结果:c(OH-)-c(HA)=10-9mol/L.
4.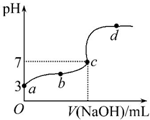 已知在25℃条件下向10.00mL 0.1mol•L-1HCOOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
已知在25℃条件下向10.00mL 0.1mol•L-1HCOOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
 已知在25℃条件下向10.00mL 0.1mol•L-1HCOOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
已知在25℃条件下向10.00mL 0.1mol•L-1HCOOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )| A. | a点表示的溶液中c(HCOO-)约为10-3mol•L-1 | |
| B. | 用25 mL的酸式滴定管量取HCOOH溶液 | |
| C. | c点NaOH溶液的体积小于10 mL | |
| D. | 在a、c间任一点,溶液中一定都有c(HCOO-)>c(Na+)>c(H+)>c(OH-) |
11.25℃时,向a mL 2.0mol•L-1的NaOH溶液中加入2.0mol•L-1的醋酸溶液,当加入bmL醋酸溶液时,混合溶液的pH为7,假设混合溶液的体积为(a+b)mL,已知,醋酸的电离平衡常数1.75×10-5,则$\frac{a}{b}$的值为( )
| A. | $\frac{175}{176}$ | B. | $\frac{100}{99}$ | C. | $\frac{99}{100}$ | D. | $\frac{1}{2}$ |
9.下列说法正确的是( )
| A. | 有的共价化合物在液态时也能导电 | |
| B. | 含有离子键的化合物中,也可能还含有共价键 | |
| C. | 形成离子键的微粒必须是金属阳离子与阴离子 | |
| D. | 非金属元素形成的化合物一定不存在离子键 |

 常温下有0.1mol•L-1五种溶液NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4.
常温下有0.1mol•L-1五种溶液NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4.