题目内容
1.某元素原子的结构示意图为 ,关于该原子说法正确的是( )
,关于该原子说法正确的是( )| A. | 核电荷数为32 | B. | 核外电子数为6 | ||
| C. | 有3个电子层 | D. | 比其阴离子多2个电子 |
分析 根据原子结构示意图,由核外电子层数即元素在元素周期表的周期数,由最外层电子数可判断该元素的族序数及在化学变化中的性质,电子总数等于质子数.
解答 解:A.电子总数等于质子数等于核电荷数,所以核电荷数为:16,故A错误;
B.该元素的原子电数为16;故B错误;
C.该元素的原子核外有3个电子层,故C正确;
D.比其阴离子少2个电子,故D错误.
故选C.
点评 本题考查了原子结构示意图,最外层电子数判断族序数,核外电子层数即元素在元素周期表的周期数,难度不大.

练习册系列答案
相关题目
11.25℃时,向a mL 2.0mol•L-1的NaOH溶液中加入2.0mol•L-1的醋酸溶液,当加入bmL醋酸溶液时,混合溶液的pH为7,假设混合溶液的体积为(a+b)mL,已知,醋酸的电离平衡常数1.75×10-5,则$\frac{a}{b}$的值为( )
| A. | $\frac{175}{176}$ | B. | $\frac{100}{99}$ | C. | $\frac{99}{100}$ | D. | $\frac{1}{2}$ |
12.用惰性电极电解含下列离子的水溶液,若转移电子数目相同的情况下,阴极析出质量最大的物质( )
| A. | Ag+ | B. | Cu2+ | C. | Na+ | D. | Hg2+ |
9.下列说法正确的是( )
| A. | 有的共价化合物在液态时也能导电 | |
| B. | 含有离子键的化合物中,也可能还含有共价键 | |
| C. | 形成离子键的微粒必须是金属阳离子与阴离子 | |
| D. | 非金属元素形成的化合物一定不存在离子键 |
16. 某研究性学习小组探究醋酸的溶液情况,进行了如下实验.
某研究性学习小组探究醋酸的溶液情况,进行了如下实验.
(1)取一定量的冰醋酸配制250mL 0.5000mol•L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管.
(2)用上述0.5000mol•L-1的醋酸溶液再进行稀释,为测定稀释后醋酸溶液的准确浓度,用0.2000mol•L-1的NaOH溶液对25.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
则该醋酸溶液的浓度为0.2000 mol•L-1.
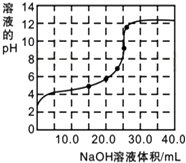
(3)实验(2)中,滴定过程中pH变化曲线如图所示(室温下).
①滴定过程中,当滴加12.50mLNaOH时,所得混合溶液中离子浓度由大到小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
②当滴加25.00mLNaOH时,反应后测得混合溶液的pH=9.则混合溶液中:水的电离度是纯水的100倍;
c(OH-)-c(CH3COOH)=10-9mol•L-1.
 某研究性学习小组探究醋酸的溶液情况,进行了如下实验.
某研究性学习小组探究醋酸的溶液情况,进行了如下实验.(1)取一定量的冰醋酸配制250mL 0.5000mol•L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管.
(2)用上述0.5000mol•L-1的醋酸溶液再进行稀释,为测定稀释后醋酸溶液的准确浓度,用0.2000mol•L-1的NaOH溶液对25.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 25.05 | 25.00 | 23.80 | 24.95 |
(3)实验(2)中,滴定过程中pH变化曲线如图所示(室温下).
①滴定过程中,当滴加12.50mLNaOH时,所得混合溶液中离子浓度由大到小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
②当滴加25.00mLNaOH时,反应后测得混合溶液的pH=9.则混合溶液中:水的电离度是纯水的100倍;
c(OH-)-c(CH3COOH)=10-9mol•L-1.
6.在氨水中存在NH3•H2O?NH4++OH-的平衡,若要使平衡向逆方向移动,同时使c(OH-)增大,应加入( )
| A. | 氯化铵固体 | B. | 硫酸 | C. | NaOH固体 | D. | 大量水 |
13.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于未来新能源标准的是( )
①天然气 ②核能 ③石油 ④太阳能 ⑤风能 ⑥氢能.
①天然气 ②核能 ③石油 ④太阳能 ⑤风能 ⑥氢能.
| A. | ①②③ | B. | ④⑤⑥ | C. | ①③⑤ | D. | ②④⑥ |
10.下列关于物质性质的比较中不正确的是( )
| A. | 碱性:KOH>NaOH>LiOH | B. | 金属性:Na>Mg>Al | ||
| C. | 原子半径:Na>S>O | D. | 酸性强弱:H3PO4>H2SO4>HClO4 |
11.下列各组物质中,化学键类型不同的是( )
| A. | NaOH和NH4NO3 | B. | H2O和NH3 | C. | CaF2和CsCl | D. | CCl4和Na2O |