题目内容
2. 想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.
想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.(1)0.1000mol•L-1NaOH溶液中由水电离出的c(OH)-=1×10-13mol•L-1
(2)滴定时用酸式(填“酸式”或“碱式”)滴定管将待测液移入锥形瓶中.
(3)若滴定时选用的指示剂是酚酞,则终点的想象是滴入最后一滴NaOH标准液,溶液由无色变为粉红色,且半分钟内不褪色
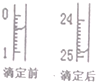
(4)中和滴定有关数据记录如下表,如图表示下表中第1次滴定时50mL滴定管中前后液面的位置
| 滴定序号 | 待测液体积(mL) | 所消耗NaOH标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 25.00 | x | y | z |
| 2 | 25.00 | 4.00 | 29.60 | 25.60 |
| 3 | 25.00 | 0.60 | 26.00 | 25.40 |
(5)根据所给数据,盐酸溶液的物质的量浓度c=0.1020mol•L-1(保留四位有效数字)
(6)下列操作会使测定结果偏高的有ad
a.洗涤碱式滴定管时未用装溶液润洗
b.洗涤时锥形瓶只用蒸馏水洗净后而未润洗
c.读所用标准液体积时,滴定前仰视,滴定后仰视
d.滴定时标准液不小心滴入到锥形瓶外面.
分析 (1)室温时,Kw=1×10-14,0.1000mol•L-1NaOH溶液中c(OH-)=1×10-1mol/L,根据c(H+)=$\frac{Kw}{c(O{H}^{-})}$以及H2O?H++OH-计算;
(2)根据酸性溶液盛放在酸式滴定管中;
(3)根据溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)根据滴定管的结构以及测量体积的原理来分析;
(5)先考虑数据的合理性,然后求体积的平均值,最后根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$计算;
(6)根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)室温时,Kw=1×10-14,0.1000mol•L-1NaOH溶液中c(OH-)=1×10-1mol/L,根据c(H+)=$\frac{Kw}{c(O{H}^{-})}$=$\frac{1×1{0}^{-14}}{1×1{0}^{-1}}$mol/L=1×10-13mol/L,又H2O?H++OH-,则由水电离的c(OH-)=c(H+)=1×10-13mol/L;
故答案为:1×10-13mol/L;
(2)待测液为盐酸,显酸性,滴定时用酸式滴定管将其移入锥形瓶中;
故答案为:酸式;
(3)酸溶液中滴加无色的酚酞,酚酞不变红,用酚酞做指示剂,滴定达到终点的现象是:滴入最后一滴NaOH标准液,溶液由无色变为粉红色,且半分钟内不褪色;
故答案为:滴入最后一滴NaOH标准液,溶液由无色变为粉红色,且半分钟内不褪色;
(4)盐酸是酸性溶液,存放在酸式滴定管中;滴定前读数为:0.40mL,滴定后读数为:24.90mL,消耗溶液的体积为24.50mL;
故答案为:24.50mL;
(5)第一次实验误差太大,舍去,求出第2组、第3组消耗的NaOH标准液的体积为25.50mL,c(待测)=$\frac{25.50×0.1000}{25.00}$mol/L=0.1020 mol/L,
故答案为:0.1020 mol/L;
(6)a.洗涤碱式滴定管时未用装溶液润洗,使氢氧化钠溶液浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,可知c(待测)偏大,故a正确;
b.洗涤时锥形瓶只用蒸馏水洗净后而未润洗,待测液的物质的量不变,V(标准)不变,所以c(待测)不变,故b错误;
c.读所用标准液体积时,滴定前仰视,滴定后仰视,无法判断V(标准)的变化,所以c(待测)无法判断,故c错误;
d.滴定时标准液不小心滴入到锥形瓶外面,造成V(标准)偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,可知c(待测)偏大,故d正确;
故选ad;
点评 本题考查中和滴定实验、滴定管结构与使用、误差分析、滴定计算等,难度不大,注意理解中和滴定的原理与滴定管的结构及精度.

| A. | 某特定反应的平衡常数只与温度有关 | |
| B. | 催化剂不能改变平衡常数的大小 | |
| C. | 平衡常数发生改变,化学平衡必发生改变 | |
| D. | 化学平衡移动时,平衡常数必改变 |
| A. | (NH4)2C2O4溶液中,c(NH4+)=2c(C2O42-) | |
| B. | 等物质的量浓度的氨水和H2C204溶液等体积混合,所得溶液呈碱性 | |
| C. | pH=11的氨水和pH=3的H2C204溶液等体积混合,所得溶液呈酸性 | |
| D. | 用H2C204溶液中和氨水至中性时,溶液中c(NH4+)=2c(C2O42-)+c(HC2O4-) |
| A. | 做过木炭还原氧化铜实验的硬质玻璃管(盐酸) | |
| B. | 长期存放氯化铁溶液的试剂瓶(稀硫酸) | |
| C. | 做过碘升华实验的试管(酒精) | |
| D. | 沾有油污的烧杯(纯碱溶液) |
| 实验编号 | HA物质的量浓度/(mol•L-1) | NaOH物质的量浓度/(mol•L-1) | 混合溶液的pH |
| 甲 | c | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH>7 |
| 丙 | 0.1 | 0.1 | pH=9 |
(2)单从乙组实验结果分析,HA是弱酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(3)丙组实验所得混合溶液中下列算式的精确结果:c(OH-)-c(HA)=10-9mol/L.
| A. | $\frac{175}{176}$ | B. | $\frac{100}{99}$ | C. | $\frac{99}{100}$ | D. | $\frac{1}{2}$ |
| A. | Ag+ | B. | Cu2+ | C. | Na+ | D. | Hg2+ |