题目内容
6.室温时,将浓度和体积分别为C1、V1的NaOH溶液和C2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是( )| A. | 若pH>7时,则一定是C1V1>C2V2 | |
| B. | 若pH<7时,混合溶液中可能有c(Na+)>c(H+) | |
| C. | 当pH=7时,若V1=V2,则一定是C2=C1 | |
| D. | 若 V1=V2,C1=C2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
分析 A.醋酸钠是强碱弱酸盐,其溶液呈碱性,如果混合溶液pH>7,溶液中溶质可能为醋酸钠,也可能为醋酸钠和少量醋酸,或者醋酸钠和氢氧化钠;
B.若pH<7,为醋酸钠、醋酸混合溶液,醋酸的电离程度大于醋酸根水解程度,醋酸钠浓度大于醋酸浓度时存在;
C.醋酸钠溶液呈碱性,pH=7时溶液呈中性,醋酸物质的量应该稍微大些;
D.根据物料守恒判断.
解答 解:A.醋酸钠是强碱弱酸盐,其溶液呈碱性,如果混合溶液pH>7,溶液中溶质可能为醋酸钠,也可能为醋酸钠和少量醋酸,或者醋酸钠和氢氧化钠,当pH>7时,可能c1V1=c2V2,也可能是c1V1<c2V2,或者c1V1>c2V2,故A错误;
B.若pH<7,为醋酸钠、醋酸混合溶液,醋酸的电离程度大于醋酸根水解程度,醋酸钠浓度大于醋酸浓度时存在c(Na+)>c(H+),故B正确;
C.醋酸钠是强碱弱酸盐,其溶液呈碱性,如果混合溶液pH=7,溶液呈中性,醋酸物质的量应该稍微大些,即c1V1<c2V2,若V1=V2,则一定是c2>c1,故C错误;
D.若V1=V2,c1=c2,两溶液中溶质NaOH与醋酸的物质的量相等,根据物料守恒得c(CH3COO-)+c(CH3COOH)=c(Na+),故D正确;
故选AC.
点评 本题考查酸碱混合溶液定性判断及离子浓度大小比较,注意任何电解质溶液中都存在电荷守恒和物料守恒,注意溶质组成与溶液酸碱性关系的判断.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
13.下列有关说法正确的是( )
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | pH=3的醋酸溶液中:c(H+)=c(CH3COO-)=3.0mol•L-1 | |
| C. | 某溶液中由水电离出的c(OH-)=1×10-amol•L-1,若a>7时,则该溶液的pH可能为a | |
| D. | 常温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+ )>c(H+)>c(OH-) |
14.洗涤下列仪器时,选用的试剂(括号中的物质)不正确的是( )
| A. | 做过木炭还原氧化铜实验的硬质玻璃管(盐酸) | |
| B. | 长期存放氯化铁溶液的试剂瓶(稀硫酸) | |
| C. | 做过碘升华实验的试管(酒精) | |
| D. | 沾有油污的烧杯(纯碱溶液) |
14.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,c是否一定等于0.2否(选填“是”或“否”).
(2)单从乙组实验结果分析,HA是弱酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(3)丙组实验所得混合溶液中下列算式的精确结果:c(OH-)-c(HA)=10-9mol/L.
| 实验编号 | HA物质的量浓度/(mol•L-1) | NaOH物质的量浓度/(mol•L-1) | 混合溶液的pH |
| 甲 | c | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH>7 |
| 丙 | 0.1 | 0.1 | pH=9 |
(2)单从乙组实验结果分析,HA是弱酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(3)丙组实验所得混合溶液中下列算式的精确结果:c(OH-)-c(HA)=10-9mol/L.
11.25℃时,向a mL 2.0mol•L-1的NaOH溶液中加入2.0mol•L-1的醋酸溶液,当加入bmL醋酸溶液时,混合溶液的pH为7,假设混合溶液的体积为(a+b)mL,已知,醋酸的电离平衡常数1.75×10-5,则$\frac{a}{b}$的值为( )
| A. | $\frac{175}{176}$ | B. | $\frac{100}{99}$ | C. | $\frac{99}{100}$ | D. | $\frac{1}{2}$ |
18.下列实验的操作或所用的试剂有错误的是( )
| A. | 实验室制取乙烯气体时,将温度计的水银球放入液面以下 | |
| B. | 可用酒精洗涤沾有苯酚的试管 | |
| C. | 证明分子CH2=CH-CHO既含有醛基又含有碳碳双键,可先向溶液中先加入足量的银氨溶液加热,充分反应后,再加入足量的溴水 | |
| D. | 苯中混有苯酚,加浓溴水,然后过滤 |
15.在一定温度下,向饱和烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是( )
| A. | 溶液中Na+浓度增大,有O2放出 | B. | 溶液pH值不变,有H2放出 | ||
| C. | 溶液中Na+数目减少,有O2放出 | D. | 溶液中pH值增大,有O2放出 |
16.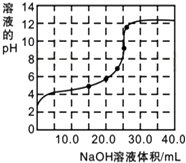 某研究性学习小组探究醋酸的溶液情况,进行了如下实验.
某研究性学习小组探究醋酸的溶液情况,进行了如下实验.
(1)取一定量的冰醋酸配制250mL 0.5000mol•L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管.
(2)用上述0.5000mol•L-1的醋酸溶液再进行稀释,为测定稀释后醋酸溶液的准确浓度,用0.2000mol•L-1的NaOH溶液对25.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
则该醋酸溶液的浓度为0.2000 mol•L-1.
(3)实验(2)中,滴定过程中pH变化曲线如图所示(室温下).
①滴定过程中,当滴加12.50mLNaOH时,所得混合溶液中离子浓度由大到小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
②当滴加25.00mLNaOH时,反应后测得混合溶液的pH=9.则混合溶液中:水的电离度是纯水的100倍;
c(OH-)-c(CH3COOH)=10-9mol•L-1.
 某研究性学习小组探究醋酸的溶液情况,进行了如下实验.
某研究性学习小组探究醋酸的溶液情况,进行了如下实验.(1)取一定量的冰醋酸配制250mL 0.5000mol•L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管.
(2)用上述0.5000mol•L-1的醋酸溶液再进行稀释,为测定稀释后醋酸溶液的准确浓度,用0.2000mol•L-1的NaOH溶液对25.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 25.05 | 25.00 | 23.80 | 24.95 |
(3)实验(2)中,滴定过程中pH变化曲线如图所示(室温下).
①滴定过程中,当滴加12.50mLNaOH时,所得混合溶液中离子浓度由大到小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
②当滴加25.00mLNaOH时,反应后测得混合溶液的pH=9.则混合溶液中:水的电离度是纯水的100倍;
c(OH-)-c(CH3COOH)=10-9mol•L-1.