题目内容
7.化学反应 A2+B2═2AB 的能量变化如图所示,则下列说法正确的是( )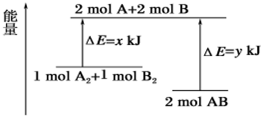
| A. | 该反应是吸热反应 | |
| B. | 断裂 1mol A-A 键和 1mol B-B 键能放出xkJ 的能量 | |
| C. | 断裂 2mol A-B 键需要吸收ykJ 的能量 | |
| D. | 2mol AB 的总能量高于 1 mol A2和 1mol B2的总能量 |
分析 A、根据反应物的能量高于生成物的能量时,反应是放热反应;
B、根据旧键的断裂吸收能量,新键的形成释放能量;
C、形成2molA-B键放出的能量与断裂2mol A-B键吸收的能量相等;
D、根据图象可判断反应物与生成物的总能量.
解答 解:A、因反应物的能量高于生成物的能量时,反应是放热反应,故A错误;
B、因旧键的断裂吸收能量,而不是释放能量,故B错误;
C、由图可知形成2molA-B键需要放出ykJ能量,因此断裂2mol A-B键需要吸收ykJ的能量,故C正确;
D、由图可知,1molA2和1molB2的总能量高于2molAB的总能量,故D错误;
故选C.
点评 本题考查学生有关化学反应中的能量变化知识,难度不大,注意基础的掌握.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
18.如表是实验室制备气体的有关内容:
(1)上述气体中从制备过程看,必须选择合适的氧化剂才能实现的是Cl2(填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是SO2;
(2)根据表中所列实验原理,从如图1装置中选择合适的气体发生装置,将其编号填入上表中的空格中.

(3)某学习小组设计了如图2实验,将氯气依次通过下列装置以验证氯气的性质:
①通入氯气后,A中的现象是溶液变蓝色,整套实验装置存在的明显缺陷是无尾气吸收装置;
②C装置中发生反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl-.
③该小组同学欲设计一个实验,证明洗气瓶B中的Na2SO3己被氧化.具体操作为:取一定量的B中溶液于一洁净的试管中,向其中加入硝酸酸化的硝酸钡溶液后,若产生白色沉淀则证明已经被氧化.你认为否 (填“是”或“否”)合理?
| 编号 | 实验内容 | 实验原理 | 气体发生装置 |
| ① | 制备氧气 | H2O2→O2 | Ⅲ |
| ② | 制备二氧化硫 | Na2SO3→SO2 | Ⅲ |
| ③ | 制备氯气 | HCl→Cl2 | Ⅰ或Ⅲ |
(2)根据表中所列实验原理,从如图1装置中选择合适的气体发生装置,将其编号填入上表中的空格中.

(3)某学习小组设计了如图2实验,将氯气依次通过下列装置以验证氯气的性质:
①通入氯气后,A中的现象是溶液变蓝色,整套实验装置存在的明显缺陷是无尾气吸收装置;
②C装置中发生反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl-.
③该小组同学欲设计一个实验,证明洗气瓶B中的Na2SO3己被氧化.具体操作为:取一定量的B中溶液于一洁净的试管中,向其中加入硝酸酸化的硝酸钡溶液后,若产生白色沉淀则证明已经被氧化.你认为否 (填“是”或“否”)合理?
15.如表列出了①~⑧八种元素在周期表中的位置:
请按要求回答下列问题:
(1)②、③、④三种元素的最高价氧化物对应的水化物,其中碱性最强的是NaOH(填写化学式).
(2)②、③、⑥三种元素按原子半径由大到小的顺序排列为K>Na>Mg(用元素符号表示).
(3)元素①的气态氢化物的电子式是 .写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(4)元素⑨的原子结构示意图是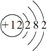 .
.
元素⑤的单质的导电性介于导体和绝缘体之间,因此是一种良好的半导体材料.
(5)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(6)用离子方程式证明⑦⑧两元素非金属性的强弱Cl2+2Brˉ═Br2+2Clˉ.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑦ | |||
| 4 | ⑥ | ⑧ |
(1)②、③、④三种元素的最高价氧化物对应的水化物,其中碱性最强的是NaOH(填写化学式).
(2)②、③、⑥三种元素按原子半径由大到小的顺序排列为K>Na>Mg(用元素符号表示).
(3)元素①的气态氢化物的电子式是
 .写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.(4)元素⑨的原子结构示意图是
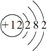 .
.元素⑤的单质的导电性介于导体和绝缘体之间,因此是一种良好的半导体材料.
(5)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(6)用离子方程式证明⑦⑧两元素非金属性的强弱Cl2+2Brˉ═Br2+2Clˉ.
2.在周期表主族元素中,X 元素位于第二周期,且分别与 Y、Z、W 三元素相邻,X、Y 的原子序数之和等于 Z的原子序数;这四种元素原子的最外层电子数之和为 20.下列判断正确的是( )
| A. | 原子序数:Z>Y>X>W | |
| B. | X、Y、Z、W 形成的单质最多有 6 种 | |
| C. | X 元素最高价氧化物对应水化物的化学式为:H3XO4 | |
| D. | 四种元素的气态氢化物中,W 的气态氢化物最稳定 |
12.在单质的晶体中,一定不存在的粒子是( )
| A. | 原子 | B. | 分子 | C. | 阳离子 | D. | 阴离子 |
19.以 NA表示阿伏加德罗常数的值,下列说法正确的是( )


| A. | 18g 冰(图甲)中含 O-H 键数目为 4NA | |
| B. | 28g 晶体硅(图乙)中含有σ键数目为 2NA | |
| C. | 44g 干冰(图丙)中含有 NA个晶胞结构单元 | |
| D. | 石墨烯(图丁)是碳原子单层片状新材料,12g 石墨烯中含π键数目为 1.5NA |