题目内容
16.向NaHCO3溶液中加入过量澄清石灰水的离子方程式:HCO3-+Ca2++OH-=CaCO3↓+H2O.分析 向NaHCO3溶液中加入过量澄清石灰水,NaHCO3完全反应生成碳酸钙、水、NaOH,据此写出反应的离子方程式.
解答 解:氢氧化钙过量,NaHCO3完全反应,反应生成碳酸钙、水、NaOH,反应的离子反应为:HCO3-+Ca2++OH-=CaCO3↓+H2O,
故答案为:HCO3-+Ca2++OH-=CaCO3↓+H2O.
点评 本题考查了离子方程式的书写,题目难度不大,明确离子方程式的书写原则为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
6.目前用于制造环保餐具的一种生物塑料是PHB,它的最大特点是废弃物易于处理,其结构式为 ,下列关于PHB的叙述中不正确的是( )
,下列关于PHB的叙述中不正确的是( )
 ,下列关于PHB的叙述中不正确的是( )
,下列关于PHB的叙述中不正确的是( )| A. | 它能发生水解反应 | |
| B. | 它在微生物作用下可降解成CO2和水 | |
| C. | 它可能是由一种含羟基的羧酸经缩聚反应而得 | |
| D. | 制备它的单体为HCOOH和CH3CH2CH2OH |
7.化学反应 A2+B2═2AB 的能量变化如图所示,则下列说法正确的是( )
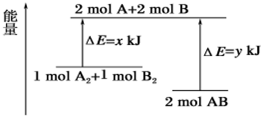

| A. | 该反应是吸热反应 | |
| B. | 断裂 1mol A-A 键和 1mol B-B 键能放出xkJ 的能量 | |
| C. | 断裂 2mol A-B 键需要吸收ykJ 的能量 | |
| D. | 2mol AB 的总能量高于 1 mol A2和 1mol B2的总能量 |
11.下列制取单质的反应中,化合物作还原剂的是( )
| A. | 用锌和稀硫酸反应制取氢气 | B. | 用氢气高温还原氧化铜得到单质铜 | ||
| C. | 用碳和高温水蒸气反应制取氢气 | D. | 用氯气和溴化钠溶液反应制取溴 |
1.在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是( )
| A. | SiO2、N2O5、CO、Cl2 | B. | Al2O3、Cl2、N2O5、SO3 | ||
| C. | CO2、Al(OH)3、CaO、SO2 | D. | Al2O3、CO2、SO3、SO2 |
4.需要加入氧化剂才能实现下列反应的是( )
| A. | Zn-→Zn2+ | B. | H+-→H2 | C. | MnO2-→Mn2+ | D. | Cl2-→Cl- |