题目内容
2.在周期表主族元素中,X 元素位于第二周期,且分别与 Y、Z、W 三元素相邻,X、Y 的原子序数之和等于 Z的原子序数;这四种元素原子的最外层电子数之和为 20.下列判断正确的是( )| A. | 原子序数:Z>Y>X>W | |
| B. | X、Y、Z、W 形成的单质最多有 6 种 | |
| C. | X 元素最高价氧化物对应水化物的化学式为:H3XO4 | |
| D. | 四种元素的气态氢化物中,W 的气态氢化物最稳定 |
分析 在周期表主族元素中,X元素位于第二周期,且分别与Y、Z、W三种元素相邻,X、Y的原子序数之和等于Z的原子序数,则X、Y处于第二周期,X、Z处于同一主族,X、Z二者原子序数相差8,故Y为氧元素,X为氮元素,Z为磷元素;这四种元素原子的最外层电子数之和为20,所以W的最外层电子数为20-5-5-6=4,故W为碳元素,据此结合元素周期律知识解答.
解答 解:在周期表主族元素中,X元素位于第二周期,且分别与Y、Z、W三种元素相邻,X、Y的原子序数之和等于Z的原子序数,则X、Y处于第二周期,X、Z处于同一主族,X、Z二者原子序数相差8,故Y为氧元素,X为氮元素,Z为磷元素;这四种元素原子的最外层电子数之和为20,所以W的最外层电子数为20-5-5-6=4,故W为碳元素,
A.X为N,则Y为O,Z为P,W为C,原子序数:Z>Y>X>W,故A正确;
B.这四种元素的单质多于6种:C可以是金刚石和石墨两种,N是氮气(N2),O是氧气(O2)和臭氧(O3),P是白磷(P4)和红磷,故B错误;
C.X元素最高价氧化物对应水化物的化学式为:HXO3,故C错误;
D.四种元素的气态氢化物中,Y为O,非金属性最强,则气态氢化物最稳定,故D错误;
故选A.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,注意根据元素在周期表中的位置以及原子结构特点正确推断元素的种类为解答该题的关键.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
12.下列离子方程式正确的是( )
| A. | 铜片插入硝酸银溶液中:Cu+2Ag+═Cu2++2Ag | |
| B. | 硫酸和氢氧化铜溶液混合:H++OH-═H2O | |
| C. | 石灰石中加入稀盐酸:CO32-+2H+═CO2↑+H2O | |
| D. | 硫酸和氢氧化钡溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
13.下列各组中的反应,属于同一反应类型的是( )
| A. | 由乙醇与浓H2SO4制备乙烯;则乙烯与水反应制备乙醇 | |
| B. | 由甲苯与液溴制备邻溴甲苯;由苯制备硝基苯 | |
| C. | 由乙醛与O2制备乙酸;由乙醛与H2制备乙醇 | |
| D. | 由油酸甘油酯与H2制备硬脂酸甘油酯;由硬脂酸甘油酯制备硬脂酸 |
17.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.8gD2O 分子中含有的质子数为 NA | |
| B. | 常温下,7.8gNa2O2中含有的阴离子个数为 0.1NA | |
| C. | 标准状况下,11.2L 18O2中所含中子数为 8NA | |
| D. | 25℃时,2.24 LCO2分子中共用电子对数目为 0.4NA |
7.化学反应 A2+B2═2AB 的能量变化如图所示,则下列说法正确的是( )
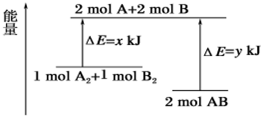

| A. | 该反应是吸热反应 | |
| B. | 断裂 1mol A-A 键和 1mol B-B 键能放出xkJ 的能量 | |
| C. | 断裂 2mol A-B 键需要吸收ykJ 的能量 | |
| D. | 2mol AB 的总能量高于 1 mol A2和 1mol B2的总能量 |
14.如图是冰部分结构图,下列有关说法正确的是( )


| A. | 因水分子间存在氢键,所以水加热到很高的温度都难以分解 | |
| B. | 1mol 冰中最多含有 4×6.02×1023个氢键,水分子间的氢键可表示为 O-H…O | |
| C. | 在“H2O(s)→H2O(l)→H2+O2”的变化过程中,被破坏的主要作用依次是氢键、极性键 | |
| D. | 等质量的水和冰,因水结冰后氢键数目变少,所以冰的密度比水小 |
11.下列制取单质的反应中,化合物作还原剂的是( )
| A. | 用锌和稀硫酸反应制取氢气 | B. | 用氢气高温还原氧化铜得到单质铜 | ||
| C. | 用碳和高温水蒸气反应制取氢气 | D. | 用氯气和溴化钠溶液反应制取溴 |
